Изучение ХТП ведут с 2-х позиций: создание самого процесса, т.е. разработка процесса и сооружение цеха установки для получения данного продукта и эксплуатация производства. Процесс создания химического производства складывается из следующих операций:
1) разработка химико-технологического процесса;
2)составление проектной документации;
3) построение цеха, т.е. сооружение здания монтаж оборудования, размещение аппаратов и приборов автоматического контроля регулирования.
Технология – наука о способах и процессах производства промышленных продуктов из природного сырья.
Технология – совокупность знаний о способах и средствах проведения производственных процессов. Технология – это наука изучающая производства (от греческого слова «техно» - искусство, ремесло или производство, «логос» - учение, наука).
Технология делится на механическую и химическую.
В механической технологии рассматривают процессы, в которых изменяется форма или внешний вид и физические свойства. Пример: изготовление детали из заготовок, дробление руды, испарение конденсация и другие.
В химической технологии рассматриваем процессы коренного изменения состава, свойств и внутреннего строения вещества. Пример:
Это деление в значительной степени условно, т.к. при изменении вида материала часто меняются его состав и химические свойства. Пример: литейное производство относится к механической технологии, но при литье металлов происходят и химические реакции.
Способ производства – это совокупность всех операций, которые проходит сырье до получения из него продукта. Способ производства слагается из последовательных операций, протекающих в соответствующих машинах или аппаратах.
Взаимосвязь между отдельными аппаратами и реакторами с описанием происходящих в них процессов называют технологической схемой.
Технологическая схема – описательное или схематическое изображение соединенных между собой машин и аппаратов, или же последовательным условным обозначением между связанных операций (процессов).
Значение и развитие химической промышленности.
Химическая технология, как наука призвана обеспечить страну требуемым количеством продуктов путем химической переработки природного сырья.
Химическая технология иногда предусматривает не выпуск продукции, а переработку токсичных отходов в менее токсичные или в товарные продукты. Триумфом советской химии был пуск в 1932 г. первого в мире завода «Синтетического каучука» по способу Лебедева С.В. Из продуктов нефтепереработки получают синтетический каучук. Из нефтехимического сырья получают: полипропилен, полиэтилен, резину и другие полимерные материалы. Из угля, воды и азота воздуха получают аммиак и азотную кислоту, а из них минеральные удобрения, ракетное топливо и т.д. На ОАО «Сода» из известняка и поваренной соли получают кальцинированную соду, применяемую в стекольной, целлюлозно-бумажной, текстильной и пищевой промышленности. На ЗАО «Каустик» из воды и поваренной соли получают хлор и каустическую соду, гидроксид натрия и водородный хлор, применяется для получения H2SO4, полимерных материалов, различных растворителей, лаков, красок, хлоркаучуков. Также NaOH находит широкое применение в текстильной, пищевой, медицинской и во многих других отраслях промышленности. Водород применяется в процессах гидрирования. За водородом будущее энергетики. Водород – экологически чистое топливо.
Химическая переработка каменного угля, нефти, торфа, природного газа позволяет получать такие важные продукты как кокс, моторное топливо, горюче-смазочные материалы (ГСМ), горючие газы и большое количество органических веществ.
Принцип принятый при разработке химической технологии («дешевле – проще») привел к тому, что химическая промышленность стала одной из отсталых отраслей промышленности, отсталость проявляется особенно в экологическом отношении. Пример: в производстве кальцинированной соды сырьем служит карбонат кальция СаСО3, хлорид натрия NaCl, аммиак и Н2О используется, оксид углерода (IV) СО2 и натрий Na – все остальное сбрасывается в канализацию («белые моря»).
Таким образом, химическая промышленность является одним из основных источников загрязнения атмосферы, воды и почвы вредными веществами.
В атмосфере происходят дальнейшие химические процессы.
Пример: Сера (S) при сгорании на воздухе образует оксид серы:
S + O2 ® SO2,
в свою очередь оксид серы при взаимодействии с водой образует серную кислоту H2SO4.
S + О2®SO2 + Н2О ® H2SO4. 
В стратосфере О2 под действием ультрафиолетовых лучей превращается в озон
3О2↔2О3 (λ – ультрафиолетовые лучи)
Ультрафиолетовое излучение затрачивается в этом обратимом процессе. Все живое не предохраняется от разрушительного воздействия ультрафиолетового излучения. Галогены: фрионы, окислы азота попадая в озоновый слой разрушают его. Эта проблема озоновой дыры. Загрязнение атмосферы оксидом углерода СО2 нарушает соотношение оксида углерода к кислороду (СО2: О2), необходимое для фотосинтеза и живого организма. Загрязнение водоемов углеводородами приводит к расходу кислорода в воде, которое ведет к кислородному голоданию живых организмов.
Главными задачами технического процесса в химической технологии являются повышение производительности труда, улучшение качества продукции, снижение себестоимости продукции и снижение вредного воздействия на окружающую среду.
Развитие химической промышленности должно быть направлено на:
1) увеличение масштабов производства; мощностей химико-технологических систем (ХТС) и химико-технологических процессов (ХТП).
2) Интенсификация работы аппаратов.
3) Снижение энергозатрат и максимальное использование теплоты химических реакций.
4) Уменьшение количества стадий производства и переход к замкнутым циклам.
5) Замена периодических процессов непрерывными процессами.
6) Механизация трудоемких операций и автоматизация производства.
7) Создание малоотходных и безотходных производств.
Основные технологические понятия и определения.
Общая химическая технология изучает теоретические основы химических процессов, протекающих в реакторах, а также способы оформления химико-технологических процессов.
Реактор – аппарат в котором протекает химическая реакция.
Технологическая схема процесса получения продуктов
по реакции  может быть изображена следующим образом:
может быть изображена следующим образом:
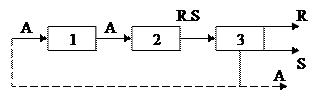
|
2 – химическое превращение (реакторный узел)
3 – выделение целевого продукта (разделение продуктов реакции).
В 1-й стадии протекают только физические процессы и реагент А химически неизмененным переходит во 2-ю стадию, где происходит химическая реакция и образуется продукты R и S. Обычно реакция не идет до конца и часть реагента А остается без изменений. В 3-й стадии происходит разделение продуктов: на R – целевой продукт и S – побочный продукт и оставшийся реагент А который может быть возращен в начальную стадию процесса. В 3-й стадии химических превращений нет
1стадия – относится к физическим процессам,
2стадия – к химическим процессам,
3стадия – к физико-химическим процессам.
Показателем эффективности работы аппарата, цеха, производства, завода в целом служит производительность.
Производительность – количество выработанного продукта или переработанного сырья в единицу времени. Обозначается буквой П.
П=G/t, или П=VB/τ
где G (или VB) – кол-во продукта,
t - время.
Единицы измерения [кг/ч; т/ч; т/сутки)]
Максимально возможная производительность называется мощностью. Для сравнения эффективности работы различных аппаратов, в которых протекают одни и те же химические процессы, вводят понятие интенсивности.
Интенсивность – производительность, отнесенная к какой-либо величине, характеризующей размеры аппарата (к его объему или площади сечения, длине аппарата).
И=П/Vp=G/Vp×t - интенсивность.
Где Vp – объем реактора,
G – количество продукта,
П – производительность.
Интенсивность может измеряется количеством продукта, получаемого в течение единицы времени с единицы объема аппарата [кг/час×м3, т/сут.м2]. Расход сырья, воды, энергии и различных реагентов отнесенный к единице целевого продукта называются расходным коэффициентом.
b = Q/G [т/т]
b – расходный коэффициент,
Q – расход сырья,
G – кол-во продукта.
Единица измерения [м3/кг, кВт ч/кг]
Степень превращения – отношение количества реагента вступившего в реакцию, к его исходному количеству.
Пример: Для простой необратимой реакции типа А®R степень превращения выражается
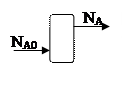
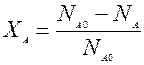
ХА – степень превращения реагента А.
NA,O, NA – количество исходного реагента А в начале и в конце процесса.
Иногда степень превращения ХА выражается в %
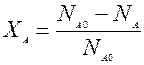 ∙100%
∙100%
Если реакция протекает без изменения объема, то степень превращения выражается через концентрацию:
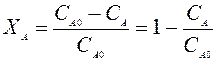

СА,О, СА – концентрация исходного реагента А в конце и начале процесса.
Выход продукта – отношение количества полученного целевого продукта к его количеству, которое должно быть получено по стехиометрическому уравнению.
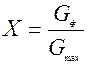 или Х =
или Х = 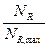
Это отношение количества фактически полученного продукта Gф и максимального Gmax, которое могло бы получиться из данного исходного продукта и обозначается X
или Х = 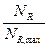
где NR − количество продукта R в конце процесса
Селективностью – называется отношение количества целевого продукта к общему количеству получаемых продуктов. Это понятие вводится для сложных реакций, т.е. когда протекают параллельные и последовательные реакции с получением нескольких продуктов.
Пусть для реакции, целевым продуктом будет R, тогда
селективность 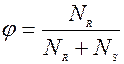
NR – количество продукта R
NS – количество продукта S
Нетрудно установить, что выход целевого продукта (Х) равен степени превращения (ХА) умноженного на селективность:
Х=ХА×j
 2014-02-02
2014-02-02 3440
3440








