Классификация химико-технологических процессов.
Химико-технологические процессы по характеру протекания процесса во времени, соответствующие аппараты и осуществляемые в них процессы делятся на: периодические и непрерывные.
Периодическими – называют процесс, в котором порция сырья и реагенты загружаются в аппарат, проходят в нем ряд стадий обработки и затем выгружаются все образовавшиеся вещества.
Недостатки этого процесса:
1) непроизводительная потеря времени при загрузочно-разгрузочных операциях.
2) механизация загрузки-выгрузки затруднена из-за отсутствия периодически действующих механизмов большой мощности
3) большая энергоемкость, т.к. сначала повышают температуру и давление, а в конце операции понижают их.
4) аппарат работает с неполной интенсивностью при выводе на режим и другие.
Однако полностью отказаться от периодических процессов нецелесообразно. Они являются незаменимыми для процессов протекающих с малой скоростью. Средняя концентрация реагентов в реакторах периодического действия (реактора смешения) выше, чем в проточных реакторах непрерывного действия, что отражается на интенсивности работы реакторов и влияет на выход продукта.
Непрерывными называются процессы, в которых поступление сырья в аппарат и выпуск продукции происходит непрерывно. Непрерывные процессы не имеют недостатков периодических процессов, нет простоев, технологические процессы протекают одновременно с вспомогательным процессом. В любой точке аппарата концентрация реагентов, температура, давление имеют определенные постоянные значения.
В классификации технологических процессов большое значение имеет необходимый для их оптимизации технологический режим.
Технологическим режимом – называется совокупность основных. факторов (параметров), влияющих на скорость процесса, выход и качества продукта. Для большинства ХТП основным параметром режима являются t, P, применение катализатора и его активность, концентрация взаимодействующих веществ, способ и степень перемешивания реагентов.
При изучении общих закономерностей химической технологии принято делить процессы и соответствующие им реакторы, прежде всего, по агрегатному (фазовому) состоянию взаимодействующих веществ. По этому признаку все системы взаимодействующих веществ и соответствующие им технологические процессы делятся на: однородные (гомогенные) и неоднородные (гетерогенные).
Гомогенными – называются такие процессы, в которых все реагирующие вещества находятся в одной какой-либо фазе: (Г, Тв, Ж). В гомогенных системах взаимодействие веществ в реакции происходит обычно быстрее, чем в гетерогенных, механизм всего технологического процесса проще и соответственно управление процессом легче, поэтому технологи на практике часто стремятся к гомогенным процессам, т.е. переводят твердые реагирующие вещества или, по крайней мере, одно из них в жидкое состояние плавлением или растворением.
Гетерогенные процессы включают 2 или большее количество фаз. Существуют следующие 2-хфазовые системы: Г-Ж, Г-Тв, Ж-Ж(несмешивающиеся), Ж-Тв, Тв-Тв. Гетерогенные процессы более распространены в промышленной практике, чем гомогенные.
При проектировании новых производств для анализа работы существующих с целью определения оптимальных значений параметров процесса составляют материальные и энергетические балансы производств.
Материальный Баланс – это вещественное выражение закона сохранения массы вещества, согласно которому во всякой замкнутой системе масса вещества, вступившая во взаимодействие равно массе веществ, образующихся в результате этого взаимодействия, т.е. приход вещества åGприход равен его расходу åGрасход. Таким образом, уравнение материального баланса можно представить в виде
åGприход = åGрасход
Для периодических процессов МБ составляют в расчете на одну операцию, для непрерывных процессов за единицу времени для установившегося режима. МБ может быть составлен для всех веществ участвующих в процессе или для одного кого-либо вещества (обычно для основного сырья).
МБ составляют для процесса в целом или для отдельных стадий. Определение массы веществ производится отдельно для твердой, жидкой, газообразной фаз.
Gт+Gг+Gж= G¢т+G¢г+G¢ж
Gт,Gг,Gж – массы твердых, газообразных и жидких веществ, поступающих в производство или на данную операцию в ед. времени.
G¢т,G¢г,G¢ж – массы веществ получаемых продуктов производств.
В производственных процессах между компонентом сырья кроме основной реакции, протекают побочные реакции. Кроме того, они возникают за счет примесей. Обычно при составлении МБ не учитывают все реакции, а лишь основные реакции, поэтому
åGприход = åGрасход+D,
где D - дебаланс (D - дельта)
Энергетический Баланс – составляют на основе закона сохранения энергии, в соответствии с которым в замкнутой системе сумма всех видов энергии постоянна. Или можно сказать так: в основу ЭБ положен закон сохранения энергии, согласно которому количество энергии, введенное в процесс, равно количеству выделяющейся энергии, т.е. приход энергии равно ее расходу.
Химико-технологические процессы связаны с затратой различных видов энергии – тепловой, механической, электрической. Поскольку в этих процессах тепловая энергия имеет наибольшее значение, то для химико-технологических процессов составляют тепловой баланс
åQприход = åQрасход
В этом случае закон сохранения энергии формулируется так: приход тепла в данной производственной операции åQприход равен расходу тепла в той же операции åQрасход.
Тепловой баланс – составляют по данным МБ с учетом тепловых эффектов химических реакций и физических превращений, протекающих в аппарате, а также с учетом подвода тепла извне и отвода ее с продуктами реакции, а также потери в окружающую среду через стенки аппарата.
В общем виде тепловой баланс выражают уравнением:
Qт+Qж+Qг+Qф+Qр+Qn= Qт¢+Qж¢+Qг¢+Qф¢+Qр¢+Qn¢
Qф¢,Qф – тепло, выделяемое и поглощаемое при физических процессах.
Qр¢, Qр – тепло, экзотермических и эндотермических реакций.
Qn – тепло, подводимое в аппарат извне.
Qn¢ – потери теплоты в окружающую среду
Qт , Qж , Qг – тепло, вносимое с поступающими в аппарат твердыми, жидкими и газообразными веществами.
Qт¢, Qж¢, Qг¢ – тепло, уносимое выходящими веществами.
(Экзо – реакция протекает с выделением энергии, эндо – реакция протекает с поглощением энергии).
Закон Г.И. Гесса (открыл в 1836) – основной закон термохимии. Термохимия – изучает тепловые эффекты химических реакций, а также теплоту образования и разбавления растворов.
Из закона Гесса: если из данных исходных веществ можно получить заданные конечные вещества различными путями, то суммарная теплота на одном каком-нибудь пути равна суммарной теплоте процесса на любом другом пути, т.е. тепловой эффект химической реакции зависит только от начального и конечного состояний системы, но не зависит от пути перехода.
Qр = – DН
DН=åDНпродукты – åDНисходных продуктов.
DН – тепловой эффект химической реакции.
Иногда Qт , Qж , Qг и Qт¢, Qж¢, Qг¢ называют теплосодержанием, каждый в отдельности определяется по формуле:
Q=C×T×G
C – теплоемкость [Дж/моль×К]
Для газообразных продуктов:
Ср=ao + a1T±a2T2
где ao, a1, a2 – табличные коэффициенты (справочник под редакцией Равделя и Понамаревой).
Теплоемкость газовой смеси определяют исходя из закона аддитивности. Аддитивность – это способность складываться целого из его частей
Ссложное целое=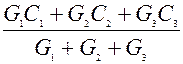
где G – масса вещества?
C – теплоемкость
Химическая, принципиальная технологическая схема химико-технологических процессов.
На первом этапе создания и строительства химико-технологического процесса (ХТП) разрабатывается химическая схема производства. Разработка химической схемы базируется на экспериментальных данных. В лабораторных условиях изучают все химические реакции, определяют механизм и кинетику основных побочных реакций, реакций превращения и утилизации отходов производства. В ходе научного поиска определяют пути осуществления химических реакций в промышленных условиях, решаются вопросы аппаратурного инженерного оформления. Критерием окончательного выбора химической системы является экономичность и экологическая безопасность производства.
Химическая схема: Производства эпихлоргидрина.
Основная 2СH2Cl – CH – CH2Cl+Ca(OH)2®2CH2 – CH-CH2Cl+CaCl2+H2O
реакция ОH гидроксид O хлорид
α и β - дихлоргидрин- кальция эпихлогидрин кальция
глицерин
Побочная реакция:
1) СН2 – СН – СН2Сl+H2O®CH2 – CH – CH2Cl α – моно-хлоргидрин
 2014-02-02
2014-02-02 6488
6488
