В ряде случаев в результате протекания параллельных реакций в реакционной массе могут образовываться два продукта (C и D), один из которых превращается в другой либо непосредственно (по реакции 3) (рис 4.1а), либо в результате обратимости первой реакции (рис. 4.1б). Какой из продуктов является основным, очень часто зависит от температурных условий проведения превращения.

Рис. 4.1. Схемы конкурентных реакций
Энергетическая диаграмма процессов, изображенных на рис. 4.1а, показывает, что образование продукта С происходит быстрее, т.к. ЕаС этой реакции заметно меньше, чем ЕаD (рис. 4.2). При низкой температуре, когда энергия реагирующих молекул невелика, основное направление реакции – образование соединения С. Этот процесс контролируется скоростью и называется кинетически контролируемой реакцией, а соединение С – продуктом кинетического контроля.
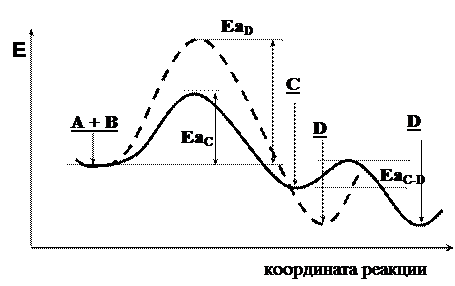 |
Рис. 4.2. Кинетический и термодинамический контроль
(последовательное превращение)
Образование соединения D требует большей энергии, поэтому при низкой температуре оно – побочный продукт. Однако продукт D термодинамически более устойчив, чем С. Поэтому с ростом температуры проведения реакции, когда большее число молекул способно перебраться через высокий энергетический барьер, в реакционной массе наблюдается преобладание продукта D. Процесс образования соединения D контролируется энергетическими факторами и называется термодинамически контролируемой реакцией. Соединение D – продукт термодинамического контроля.
Соединение С образуется быстро. Его стабильность относительно низка, а энергия активации превращения С в D (ЕаС-D) невелика. При проведении реакции при повышенной температуре (т.е. в условиях термодинамического контроля) происходит превращение соединения С в более энергетически выгодный продукт Д.
На рис. 4.3 показаны энергетические профили реакций кинетического (образование С) и термодинамического (образование D) контроля для обратимых превращений.. Причины особенностей протекания реакций аналогичны изложенным выше.
 |
Рис. 4.3. Кинетический и термодинамический контроль (обратимое превращение)
Отличается только превращение продукта кинетического контроля С в продукт термодинамического контроля D. При повышенной температуре происходит превращение соединения С в исходные вещества A и B. Процесс протекает быстро, т.к. энергия активации этого процесса незначительна. Превращение D в исходные продукты протекает значительно труднее, и он накапливается в реакционной смеси.
Образование продуктов кинетического и термодинамического контроля – классический случай протекания органических реакций. Конкретные реакции будут рассмотрены в соответствующих разделах (см., например, химические свойства 1,3-алкадиенов, лекция № 15).
 2014-02-02
2014-02-02 6585
6585








