Основания по Льюису – доноры электронной пары, как и основания по Брёнстеду.
Определение Льюиса для кислот заметно отличается от привычного (по Брёнстеду). Кислотой по Льюису считается любая молекула или ион, имеющая свободную орбиталь, которая может быть в результате взаимодействия заполнена электронной парой. Если по Брёнстеду кислота – донор протона, то по Льюису сам протон (Н+) – кислота, поскольку его орбиталь пуста. Кислот Льюиса очень много: Na+, Mg2+, SnCl4, SbCl5, AlCl3, BF3, FeBr3 и т.д. Теория Льюиса позволяет описать многие реакции как кислотно-основные взаимодействия. Например:
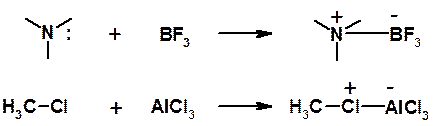
Часто в реакциях с кислотами Льюиса в качестве оснований участвуют органические соединения, являющиеся донорами пары p-электронов:
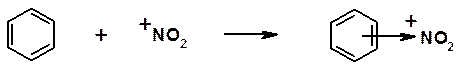
В органической химии принято следующее:
· если используется термин «кислота» - подразумевается кислота по Брёнстеду;
· если используют термин «кислота» в льюисовском понимании – говорят «кислота Льюиса».
 2014-02-02
2014-02-02 4446
4446








