Задача 1. Запишите уравнения реакций взаимодействия между следующими веществами:
а) растворами нитрата алюминия и сульфида натрия;
б) растворами хлорида алюминия и аммиака.
Решение:
А) В результате взаимодействия растворов нитрата алюминия и сульфида натрия образуются гидроксид алюминия, сероводород и нитрат натрия; образование сульфида алюминия по обменной реакции не происходит вследствие взаимного усиления гидролиза ионов Al3+ и S2-:
2Al(NO3)3 + 3Na2S + 6H2O = 2Al(OH)3 + 3H2S + 6NaNO3.
Б) При взаимодействии растворов хлорида алюминия и аммиака образуется гидроксид алюминия и хлорид аммония:
AlCl3 + 3NH3 + 3H2O = Al(OH)3 + 3NH4Cl.
Задача 2. При полном растворении алюминия в 200 г раствора соляной кислоты образовалось 23,52 л водорода (н. у.) (кислота прореагировала полностью). Вычислите массовую долю хлорида алюминия в полученном растворе.
Дано:
m (р-ра) = 200 г
V (H2) = 23,52 л
m (AlCl3) = 133,5 г/моль
Найти:
ω (AlCl3)
Решение:
Запишем уравнение реакции взаимодействия алюминия с соляной кислотой:
2Al + 6HCl = 2AlCl3 + 3H2.
Для определения массовой доли хлорида алюминия в полученном растворе необходимо знать массу образовавшегося хлорида алюминия и массу раствора:
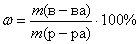 .
.
Вычислим массу образовавшегося хлорида алюминия. По уравнению реакции 2 моль хлорида алюминия соответствует 3 моль водорода. Определим количество вещества, выделившегося водорода:
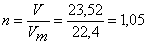 (моль),
(моль),
следовательно, образовалось 0,7 моль хлорида алюминия (1,05 · 2/3 = 0,7). Вычислим массу хлорида алюминия:
m (AlCl3) = n (AlCl3) · M (AlCl3) = 0,7 · 133,5 = 93,45 (г).
Масса полученного раствора сложится из массы образовавшегося хлорида алюминия и воды, которая содержалась в растворе кислоты. Вычислим массу воды. По уравнению реакции 6 моль HCl соответствует 3 моль водорода; если образовалось 1,05 моль водорода, то прореагировало 2,1 моль HCl (1,05 · 2 = 2,1). Масса прореагировавшего HCl равна:
m (HCl) = n (HCl) · M (HCl) = 2,1 · 36,5 = 76,65 (г),
тогда масса воды, содержащейся в растворе кислоты, равна:
m (H2O) = m (р-ра) – m (HCl) = 200 – 76,65 = 123,35 (г),
следовательно,
m (р-ра)получ. = m (AlCl3) + m (H2O) = 123,35 + 93,45 = 216,8 (г).
Определим массовую долю хлорида алюминия в полученном растворе:
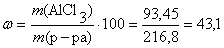 (%).
(%).
Ответ: ω (AlCl3) = 43,1 %.
 2014-02-02
2014-02-02 1268
1268
