Если окислительно-восстановительную реакцию осуществить так, чтобы процессы окисления и восстановления были пространственно разделены, и создать возможность перехода электронов от восстановителя к окислителю по проводнику (внешней цепи), то во внешней цепи возникает направленное движение электронов - электрический ток.
 Рассмотрим систему, в которой два электрода находятся в растворах своих солей. Примером может служить гальванический элемент Даниэля-Якоби (рис. 12.2), который состоит из медной и цинковой пластинок, опущенных в растворы своих солей. На поверхности цинковой пластинки устанавливается равновесие Zn Zn2+ + 2ē, которому соответствует потенциал j0 = -0,76 В (табл. 12.1). На поверхности медной пластинки устанавливается равновесие Cu Cu2+ + 2ē, которому соответствует равновесный потенциал j0 = +0,34 В.
Рассмотрим систему, в которой два электрода находятся в растворах своих солей. Примером может служить гальванический элемент Даниэля-Якоби (рис. 12.2), который состоит из медной и цинковой пластинок, опущенных в растворы своих солей. На поверхности цинковой пластинки устанавливается равновесие Zn Zn2+ + 2ē, которому соответствует потенциал j0 = -0,76 В (табл. 12.1). На поверхности медной пластинки устанавливается равновесие Cu Cu2+ + 2ē, которому соответствует равновесный потенциал j0 = +0,34 В.
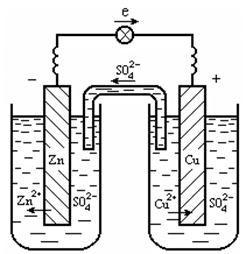
Рис. 12.2. Медно-цинковый гальванический элемент:
(1 - цинковый электрод - анод; 2 - медный электрод - катод; 3 - ионный ключ- электролит, проводящий ионы SO42-; 4 - электронный проводник)
Потенциал цинкового электрода имеет более отрицательное значение, поэтому при замыкании внешней цепи электроны будут переходить от цинка (анод) к меди (катод). В результате этого процесса равновесие на аноде (Zn) сместится вправо и в раствор перейдет дополнительное количество ионов цинка (происходит растворение анода). В то же время равновесие на медном электроде сместится влево и произойдет выделение меди на катоде.
Устройства, в которых на электродах самопроизвольно протекают окислительно-восстановительные реакции, в результате которых получается электрическая энергия, называются гальваническими элементами. Электрод, на котором протекает процесс окисления, называется анодом; другой электрод, на котором осуществляется процесс восстановления, называется катодом.
Схема гальванического элемента, заменяющая рисунок, записывается следующим образом:
Zn½Zn2+║Cu2+½Cu.
(А): Zn - 2ē = Zn2+, (окисление)
(К): Cu2+ + 2ē = Cu0, (восстановление)
Zn + Cu2+ = Zn2+ + Cu.
Суммарная реакция, протекающая в гальваническом элементе, называется токообразующей.
 2014-02-02
2014-02-02 3345
3345
