Гальванические преобразователи основаны на зависимости ЭДС гальванической цепи от концентрации ионов в электролите и окислительно восстановительных процессов, происходящих на электродах. Они используются для определения концентрации ионов в различных растворах, а также в качестве образцовых мер ЭДС – нормальных элементов.
Наиболее широкое применение гальванические преобразователи получили в качестве преобразователей рН-метров– приборов для измерения активности (концентрации) водородных ионов.
Молекулы воды частично диссоциируют на ионы водорода и ионы гидроксила ОН-, чем обусловлена вполне определенная, хотя и очень малая электропроводность воды. Диссоциация воды происходит по схеме
H2O⇆H++OH-.
При этом остается постоянной так называемая константа диссоциации, равная
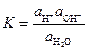 ,
,
где a H+, а OH- и a H 2 O – соответственно активности ионов Н+, ОН- и воды.
В разбавленных растворах активность воды a H 2 O можно считать постоянной, и тогда произведение Ka H 2 O становится новой постоянной, которую называют ионным произведением воды:
K H 2 O =a H +a OH -.
Установлено, что при 22 °С ионное произведение воды K H 2 O =10-14 (г-ион/л)2. В чистой воде или в нейтральном растворе активности H+ и ОН- равны:
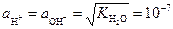 г-ион/л.
г-ион/л.
Ионное произведение воды K H 2 O =a H +a OH - при данной температуре остается постоянной величиной не только для воды, но и для любого водного раствора, включая растворы кислот с избытком ионов Н+ или оснований с избытком ионов ОН-.
Если в воде растворить кислоту, то ионов Н+ станет больше, а ионов ОН- — меньше (за счет воссоединения части образовавшихся ионов Н+ с ионами ОН-), но произведение a H +a OH - останется равным ионному произведению воды. У кислых растворов a H + > a OH -, а у щелочных растворов a OH - > a H +
Таким образом, для характеристики раствора достаточно знать активность водородных ионов, которую для удобства записи и вычислений численно характеризуют отрицательным логарифмом активности ионов водорода – водородным показателем рН:
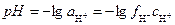 .
.
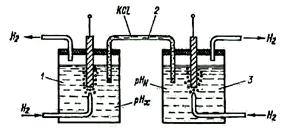
Рис. 2-46
Приборы для измерения этого показателя получили название рН-метров.
Диапазон изменения рН водных растворов обычно составляет 0–14 ед. В растворах других растворителей (неводных) диапазоны изменения рН другие, например в аммиаке 0 – 32,7 ед., в муравьиной кислоте 0–6,1 ед. и т.д.
Наиболее точный и универсальный метод измерения рН основан на определении электродных потенциалов различных электродов, помещаемых в исследуемый раствор. Следовательно, гальванические преобразователи, являющиеся датчиками рН-метров, в качестве естественной входной величины имеют концентрацию водородных ионов, выражаемую в единицах рН, а в качестве выходной величины разность электродных потенциалов.
Гальванический преобразователь состоит из двух полуэлементов: измерительного электрода, помещаемого в исследуемый раствор, и вспомогательного полуэлемента, электродный потенциал которого должен оставаться постоянным.
На рис. 2-46 показан гальванический преобразователь, состоящий из двух водородных полуэлементов. Один из водородных электродов (измерительный) помещается в исследуемый раствор 1, который при помощи электролитического ключа 2 соединяется с нормальным водородным полуэлементом (вспомогательным) 3, содержащим электролит с активностью водородных ионов а( H +) 2=1 г-ион/л. ЭДС между электродами полученной концентрационной цепи равна:
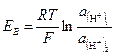 ,
,
где 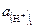 – активность водородных ионов в исследуемом растворе;
– активность водородных ионов в исследуемом растворе; 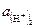 – активность водородных ионов в нормальном водородном полуэлементе.
– активность водородных ионов в нормальном водородном полуэлементе.
Переходя к десятичным логарифмам и учитывая, что lg u (h+) i = - рН, получаем
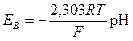
Для температуры 18 °С EB= –0,058 pH.
 2015-01-30
2015-01-30 2655
2655








