Действуют аминопептидазой и получают N-концевую аминокислоту;
2. Примененяют метод Эдмана:
Для этого белок в щелочной среде обрабатывают, например, фенилизотиоцианатом, который с NH2 образует негидролизуемую (прочную) связь.
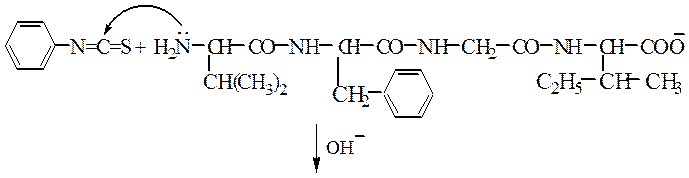
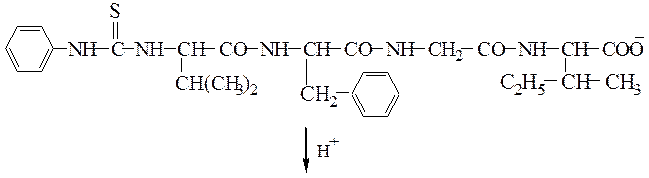 Далее кислотой гидролизуют пептидную связь и получают фенилтиогидантоиновое (ФТГ) производное валина:
Далее кислотой гидролизуют пептидную связь и получают фенилтиогидантоиновое (ФТГ) производное валина:
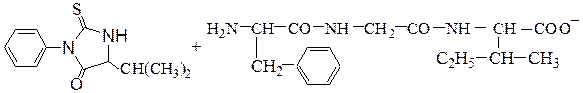
ФТГ - валин с помощью растворителей извлекают и идентифицируют хроматографией:
Далее аналогично получают фенилтиогидантоиновое фенилаланина:
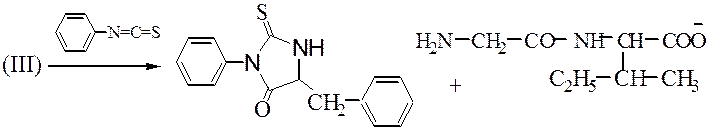
ФТГ-производные N-концевых остатков идентифицируют хроматографией. Производные поглощают свет при 265-270 нм, что используется в автоматических анализаторах - секвенаторах ( от анг. sequence – последовательность).
Определение С- концевой аминокислоты включает:
Разрушение пептидных связей под действием ферментов - протеаз, протекает специфично (избирательно):
- химотрипсин катализирует гидролиз пептидных связей, образованных карбоксильными группами ароматических α-аминокислот (Туr, Phe, Trp),
- трипсин гидролизует связи, образованные карбоксильными группами основных α-аминокислот (Lys, Arg);
- термолизин расщепляет пептидные связи, включающие аминокислотные остатки с гидрофобной боковой цепью (Ile, Leu, Val, Phe, Tyr, Trp).
 2014-02-03
2014-02-03 2745
2745








