Среди превращений аминокислот следует отметить образование дисульфидных мостиков (-S-S- связи) при ферментативном окислении двух остатков цистеина в составе уже сформированных пептидных цепей. В результате образуется остаток диаминодикарбоновой кислоты цистина:
CH2 – SH HS – CH2 CH2 – S – S – CH2
ï ï ï ï
CH – NH2 + CH – NH2 CH – NH2 CH – NH2
ï ï ï ï
COOH COOH COOH COOH
Цистеин Цистин
Свойство данной аминокислоты окисляться придает ей защитные и радиопротекторные свойства. В присутствии цистеина снижается интенсивность окислительных процессов в липидах и белках, повышается устойчивость организма к ионизирующим излучениям, стабилизируется качество лекарственных препаратов. При участии двух остатков цистеина в полипептидных цепях образуются дисульфидные связи, которые обуславливают биологическую активность в организме и функциональные свойства белков в составе пищи. Важную роль дисульфидные связи играют в белках пшеницы, так как они обуславливают упругие свойства клейковины для выпечки хлеба.
Другим примером модификации аминокислотных остатков является превращение остатков пролина в остатки гидроксипролина:
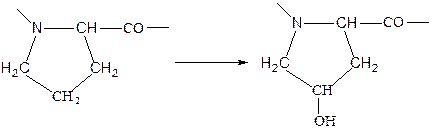
Данное превращение происходит при образовании белкового компонента соединительной животной ткани ткани – коллагена.
Еще одним весьма важным видом модификации белков является фосфорилирование гидроксигрупп остатков серина, треонина и тирозина:
– NH – CH – CO – – NH – CH – CO –
 | |
| |
CH2OH CH2OPO32 –
 2014-02-03
2014-02-03 3271
3271







