Молекулярная физика — раздел физики, изучающий строение и свойства вещества исходя из того, что все тела состоят из атомов или молекул, находящихся в непрерывном хаотическом движении.
- Возможность прямого наблюдения индивидуальных молекул и атомов в микроскоп
- Изменяемость объема газа, например его сжимаемость
- Наличие сил притяжения и отталкивания между молекулами отчетливо обнаруживается в свойстве твердых тел сохранять свою форму. Даже для небольшой деформации твердого тела необходимо приложить значительное усилие. Понятно, что растяжению тела препятствуют силы притяжения, а сжатию — силы отталкивания между молекулами.
- Непрерывное хаотическое движение молекул наиболее наглядно обнаруживается в явлениях диффузии и броуновского движения.
Если поместить капельку брома на дно высокого стеклянного сосуда, то в результате ее испарения через несколько минут около дна суда образуется слой пара брома, имеющий темно-бурый цвет. Этот пар довольно быстро распространяется кверху, перемешиваясь с воздухом, так что через час бурый столбик смеси газов в сосуде достигнет 30см. Очевидно, что перемешивание воздуха с паром брома произошло не под влиянием силы тяжести, а наоборот, вопреки действию силы тяжести, так как первоначально бром располагался ниже воздуха, а плотность пара брома приблизительно в 4 раза больше, чем воздуха.
В данном случае перемешивание могло быть вызвано только хаотическим движением молекул, в процессе которого молекулы брома распространялись между молекулами воздуха, а молекулы воздуха — между молекулами пара брома. Рассмотренное явление называется диффузией.
В 1827 г. английский ботаник Броун, исследуя под микроскопом жидкие препараты, случайно обнаружил следующее интересное явление. Взвешенные в жидкости мельчайшие твердые частички совершали быстрые беспорядочные движения, как бы перескакивая с места на место. В результате таких скачков частички описывали зигзагообразные траектории самой причудливой формы. В дальнейшем это явление неоднократно наблюдалось как самим Броуном, так и другими исследователями в различных жидкостях и с различными твердыми частичками. Чем меньше был размер частичек, тем интенсивнее они двигались. Описанное явление получило название броуновского движения.
Броуновское движение можно наблюдать, например, в капле воды, слегка подчерненной тушью или подбеленной молоком, пользуясь микроскопом с пятисоткратным увеличением. Диаметр броуновской частицы составляет в среднем 0,0001 мм, наибольший же допустимый ее диаметр — 0,005 мм.
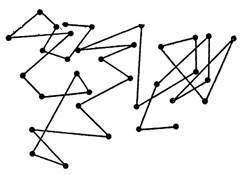
Рис. 2.
На рис. 2 представлена зарисовка траектории одной из броуновских частиц. Местоположение этой частицы отмечалось через каждые 30 с черными точками.
4. Экспериментальные законы идеального газа:
а) закон Бойля-Мариотта
б) закон Гей-Люссака
в) закон Шарля
В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Модель идеального газа можно использовать при изучении реальных газов, так как они в условиях, близких к нормальным (например, кислород и гелий), а также при низких давлениях и высоких температурах близки по своим свойствам к идеальному газу. Кроме того, внеся поправки, учитывающие собственный объем молекул газа и действующие молекулярные силы, можно перейти к теории реальных газов.
Рассмотрим законы, описывающие поведение идеальных газов.
а) Закон Бойля — Мариотта:
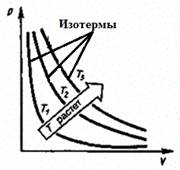
pV = const при Т = const, т = const. (1)
Процесс изотермический.
Рис. 3
 б) Закон Гей-Люссака:
б) Закон Гей-Люссака:
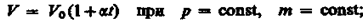 (2)
(2)
Процесс изобарный.
Рис. 4
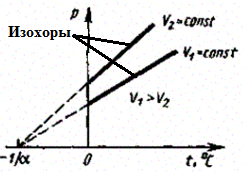 в) Закон Шарля:
в) Закон Шарля:
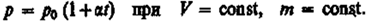 (3)
(3)
Процесс изохорный.
Рис. 5.
В этих уравнениях t — температура по шкале Цельсия, р0 и V0 — давление и объем при 0°С, коэффициент a = 1/273,15 К-1.
Закон Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При нормальных условиях этот объем равен 22,41×10-3 м3/моль.
По определению, в одном моле различных веществ содержится одно и то же число молекул, называемое постоянной Авогадро:
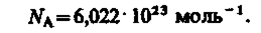
1 моль – количество вещества, содержащее столько же структурных элементов (атомов, молекул, ионов, электронов и др. частиц или группы частиц), сколько содержится атомов в изотопе 12С массой 0,012 кг.
 2021-09-14
2021-09-14 69
69








