10. Применение 1-го начала термодинамики к изопроцессам
Дело имеем с равновесными процессами. Есть состояние, есть процесс.
Изопроцессы могут протекать в равновесных условиях. Их мы и рассмотрим.
а. Изохорный процесс. V=const, m=const, 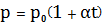
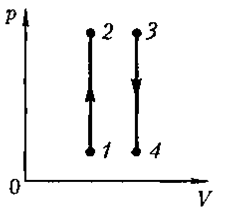 поршень в цилиндре неподвижен, Т растет.
поршень в цилиндре неподвижен, Т растет.
1 – 2 – изохора нагревания;
3 – 4 – изохора охлаждения.
При изохорном процессе
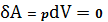 ,
,
тогда, согласно 1-му закону термодинамики,
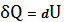 (21)
(21)
С учетом того, что
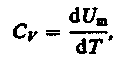
(21) примет вид
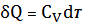 (22)
(22)
Для произвольной массы газа (22) перепишется
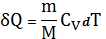 (23)
(23)
б. изобарный процесс (p=const).
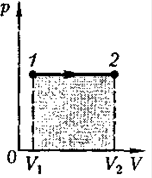
В данном случае совершается работа
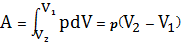 , (24)
, (24)
равная площади S под прямой.
Запишем ур-е К-М для состояний 1 и 2.
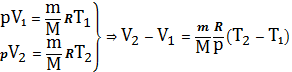 (24`)
(24`)
Подставим (24`) в (24)
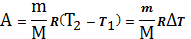 (25)
(25)
Из (25) вытекает физический смысл R
R=A при ∆T=1K 1моля газа.
Работа при изобарном расширении 1 моля идеального газа при нагревании его на 1К.
Если при изобарном процессе газу массой m сообщить тепло, равное
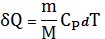 ,
,
то
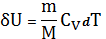 ,
,
и будет совершена работа
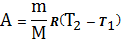 .
.
в. Изотермический процесс. Т = const, т.е. выполняется закон Бойля – Мариотта:
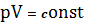
С учетом того, что
1) 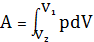
2) 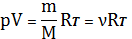
получим
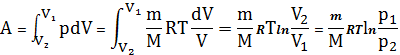 .
.
T=const, тогда 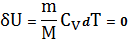 . Первое начало термодинамики запишется:
. Первое начало термодинамики запишется:
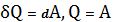 .
.
Все тепло идет на совершение работы. Следовательно,
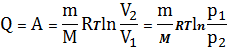 (26)
(26)
Требуется восполнение энергии системы.
11. Адиабатический процесс и уравнение Пуассона. Политропический процесс. Работа при адиабатическом процессе
Процесс, сопровождающийся без теплообмена (δQ=0), называется адиабатическим. К адиабатическим процессам близки:
- быстропротекающие процессы (поршень – цилиндр, звук в среде, холодильник)
- либо, наоборот, медленно протекающие процессы (теплообмен над озером).
В этом случае 1-е нач. термо-ки примет вид
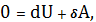
или
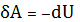 , (27)
, (27)
т.е. работа совершается за счет изменения внутренней энергии. С учетом (10) и (16) ур-е (27) примет вид:
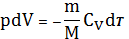 (28)
(28)
Используем ур-е состояния идеального газа в дифференциальной форме
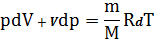 . (29)
. (29)
Разделим почленно (28) на (29). После преобразований получим
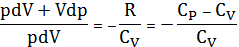 .
.
Учитывая, что
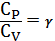
получим
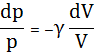 .
.
Проинтегрируем
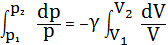 .
.
Затем, потенцируя, получим
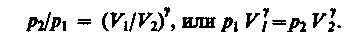
Так как состояния 1 и 2 выбраны произвольно, то можно записать
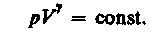 (30)
(30)
(30) – уравнение адиабатического процесса, называемое также уравнением Пуассона.
В (30) отсутствует параметр Т. его можно ввести, воспользовавшись ур-ем К-М
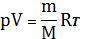 .
.
Получим
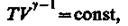 (31)
(31)
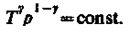 (32)
(32)
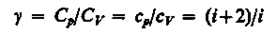 –
–
называется показателем адиабаты. Для идеальных газов γ = 1,67.
Работа, совершаемая в адиабатическом процессе, равна
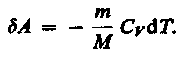
Если газ адиабатически расширяется от объема V\ до V2, то его температура уменьшается от T1до T2и работа расширения идеального газа
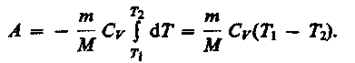 (33)
(33)
Преобразуем (33), воспользовавшись ур-ем К-М
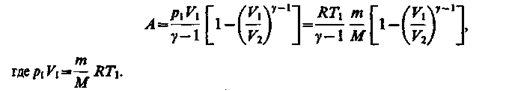
Аад < Aизотер, потому что при адиабатическом процессе Т уменьшается, а при изотермическом Т = const за счет притока тепла извне.
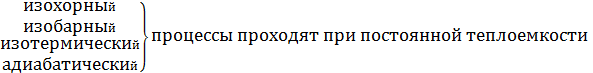
При изохорном С=СV
При изобарном С=Сp
При изотермическом (dT=0) C=±∞
При адиабатическом (δQ=0) C=0.
Процесс, в котором теплоемкость остается постоянной, называется политропным. Уравнение политропы:
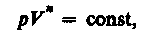 (34)
(34)
где n=(C—Cp)/(C—CV) — показатель политропы. Из (34) вытекает, что
при С=0, n = 0, (34) принимает вид 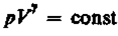 - уравнение адиабаты
- уравнение адиабаты
при С = ¥, n = 1 — уравнение изотермы pV=const
при С = Сp, n = 0 — уравнение изобары (p=const) V=V0(1+αt)
при С = СV, n = ±∞ — уравнение изохоры (V=const) p=p0(1+αt).
Т.е. рассмотренные 4 процесса являются частным случаем политропного процесса.
 2021-09-14
2021-09-14 75
75








