Введем еще одну характеристику вещества – теплоемкость.
1). Удельная теплоемкость:
С= 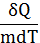 [Дж/(кг∙К)] (12)
[Дж/(кг∙К)] (12)
При m=1кг, Т=1К C=Q.
2). Молярная теплоемкость:
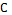 m
m 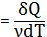 [Дж\моль∙К] (13)
[Дж\моль∙К] (13)
где 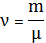
Связь С и Cm:
Сm=СM (14)
Введем в уравнение первого начало термодинамики 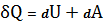 для одного моля газа (v=1)значение теплоемкости
для одного моля газа (v=1)значение теплоемкости
CmdT=dUm+PdV (15)
Если процесс изохорический (V=const), то PdVm=0, т.е. работа А внешних сил равна нулю, то Q идет только на увеличение U. Тогда:
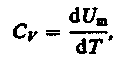 (16)
(16)
т.е Сv- молярная теплоемкость, равная изменению dU одного моля газа при Т=1К.
С учетом формулы dUm= 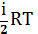
Cv= 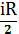 (17)
(17)
Если процесс изобарический, т.е P=const, с учетом первого начала термодинамики, записанного в форме (15), получим:
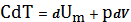
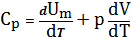
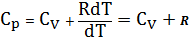
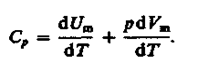
Запишем уравнение Клайперона –Менделеева одного моля газа:
PVm=RT
Продифференцируем его с учетом того, что:
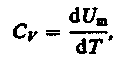
Которая не зависит от вида процесса, потому что внутренняя энергия U идеального газа не зависит ни от P, ни от V, а зависит только от T:
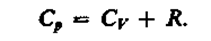 (18)
(18)
(18) – Уравнение Майера.
Из (18) видно, что Cp>Cv. Это связано с тем, что, при нагревании газа при P=const, требуется дополнительное количество Q на совершение работы А расширения газа, т.к. постоянство Р обеспечивается увеличением объема газа.
В (18) подставим значение (17), получим:
Сp=Cv+R= 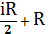 =
= 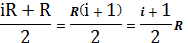 (19)
(19)
Найдем отношение 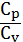 с учетом выше написанных формул. Получаем:
с учетом выше написанных формул. Получаем:
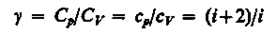 (20)
(20)
Как видно из (17) и (20), молярная теплоемкость Cm определяется лишь значением i (см. степени свободы), т.е. Cp, Cv=f(i) от Т не зависят.
Однако это утверждение справедливо только для одноатомных газов (i=3) в только широком интервале температур.
Для многоатомных газов i=f(T). Так, экспериментально установлено что, Cv принимает значения (см. рис):
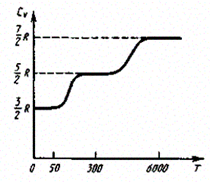
Такой ход зависимости Cv=f(i) можно объяснить предположив, что:
-при низких температурах наблюдается только поступательное движение (i=3)
-при комнатных температурах поступательное + вращательное движения
-при высоких температурах поступательное + вращательное + колебательное движения молекул.
 2021-09-14
2021-09-14 64
64








