7. Элементы статистики:
а) распределение Максвелла
Из-за хаотического движения молекул все направления движения являются равновероятными, т. е. в любом направлении в среднем движется одинаковое число молекул.
В состоянии равновесия при Т = const скорость молекул остается постоянной и равной 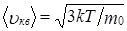 .
.
Это объясняется тем, что в газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям, которое подчиняется вполне определенному статистическому закону. Этот закон теоретически выведен Дж. Максвеллом.
При выводе закона Максвелл предположил, что:
1. газ состоит из очень большого числа N тождественных молекул
2. они находятся в хаотическом тепловом движении
3. температура газа по всему объему одинакова
4. силовые поля на газ не действуют.
Закон Максвелла предполагает разбиение диапазона скоростей молекул на малые интервалы dυ, на каждый из которых приходится некоторое число молекул dN(υ). Такой подход приводит к появлению функции распределения молекул по скоростям f (υ), позволяющей определить относительное число молекул dN(υ)/N, скорости которых лежат в интервале от υ до υ + dυ, т. е.
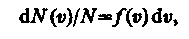
откуда
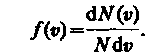
Применяя методы теории вероятностей, Максвелл нашел явный вид функции f (υ) — закон о распределении молекул идеального газа по скоростям:
 (17)
(17)
Из (17) видно, что конкретный вид функции зависит от рода газа (от массы молекулы) и от параметра состояния (от температуры Т).
Скорость, при которой функция распределения молекул идеального газа по скоростям максимальна, называется наиболее вероятной скоростью. Значение наиболее вероятной скорости можно найти, продифференцировав выражение (17) по аргументу υ, приравняв результат нулю и используя условие для максимума выражения f (υ):
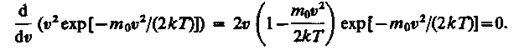
Значения υ = 0 и υ = ¥ соответствуют минимумам выражения (17), а значение υ, при котором выражение в скобках становится равным нулю, и есть искомая наиболее вероятная скорость υ b:
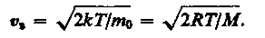 (18)
(18)
Из формулы (18) следует, что при повышении температуры максимум функции распределения молекул по скоростям (рис. 8) сместится вправо (значение наиболее вероятной скорости становится больше). Однако площадь, ограниченная кривой, остается неизменной, поэтому при повышении температуры кривая распределения молекул по скоростям будет растягиваться и понижаться.
Средняя скорость молекулы < υ > (средняя арифметическая скорость) определяется по формуле

Подставляя сюда f (υ) и интегрируя, получаем
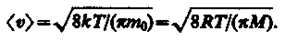 (19)
(19)
Скорости, характеризующие состояние газа: 1) наиболее вероятная
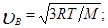 2) средняя
2) средняя 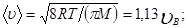 3) средняя квадратичная
3) средняя квадратичная 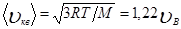 (рис. 8). Исходя из распределения молекул по скоростям
(рис. 8). Исходя из распределения молекул по скоростям
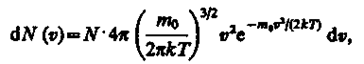 (20)
(20)
можно найти распределение молекул газа по значениям кинетической энергии e. Для этого перейдем от переменной υ к переменной e = m0 υ 2/2. Подставив в (20) 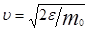 и
и 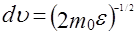 , получим
, получим
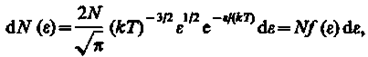
где dN(e) — число молекул, имеющих кинетическую энергию поступательного движения, заключенную в интервале от e до e + de.
Таким образом, функция распределения молекул по энергиям теплового движения
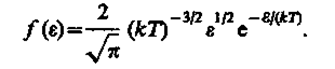
Средняя кинетическая энергия <e> молекулы идеального газа
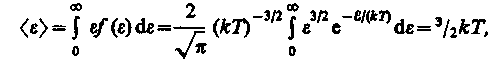
т. е. получили результат, совпадающий с формулой (16).
Вставить из Открытой физики.
8. Первое начало термодинамики
1) Для характеристики состояния и свойств Газа – (Г) мы ввели ряд параметров (характеристик): T,P,V, ν нашли связь между ними:
а) PV= const m=const, T=const - изотермический
б) V=V0(1+αt) m=const, P=const –изобарический
в) P=P0(1+αt) m=const, V=const- изохорический
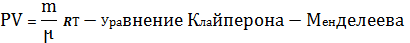
Написали основное уравнение МКТ газов
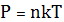
2) Ввели постоянные: -
NA=6,022 ∙1023 1/моль – число Авагадро
R=8,31 дж/моль ∙К – универсальная газовая постоянная
k=R/NA=8,31/6022∙1023 1/моль – постоянная Больцмана
Vm=22,41 ∙10-3 м3/моль – объем 1 моля любого газа
ν=V\m =1\ρ – удельный объем
NL=2,68∙1025 1\м3 – число Лошмидта (кол-во частиц в 1 м3)
Введем еще одну важную характеристику терм-ской системы: внутреннюю энергию. Обозначим –U. Она состоит из:
U=Uхаот.движ +Uвз(потенц.энерг.)
В U не учитывается:
1) Uk- энергия движения системы в целом
2) Uпот – энергия системы во внешних полях (напр. поле тяготения)
U это хар-тика каждого отдельного состояния. Это однозначная функция. Она не зависит как она пришла в данное состояние какой путь при этом она прошла.

Это означает что 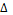 U=U1-U2, т.е. значениями U в начальном U1 и конечном U2 состояниях.
U=U1-U2, т.е. значениями U в начальном U1 и конечном U2 состояниях.
В предыдущей лекции отмечалось, что положение системы в пространстве определяется числом независимых переменных (координат): матер. (∙), например, имеет 3 степени свободы поступательного движения x,y,z. Если газ одноатомный и атомы в нем приняты за материальную точку, то данному атому можно приписать также 3 степени свободы поступательного движения. При этом энергия вращения движения равна нулю, т.к. r ® 0, J = mr2 ® 0, т.е. момент инерции равен нулю. Поэтому
Екин вращ=J 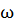 2\2, J=0→ Екин.вращ=0
2\2, J=0→ Екин.вращ=0
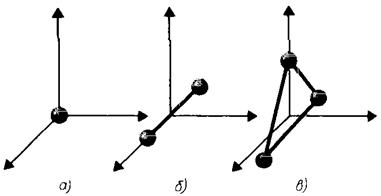
Рис. 1.
Обозначим степени свободы через i. По аналогии, если газ двухатомный, т.е. две материальные точки, то i=5 степеней свободы, т.к. требуется 2 степени свободы на вращательное движение
Если газ трехатомный, т.е. три материальные точки, то требуется 3 степени свободы на три вращательных движения.
Понятно, что атомы участвуют еще и в других видах движения, а именно в колебательных. Т.е. они тоже имеют степень свободы. Об этом чуть позже.
3 поступательных степени свободы имеются всегда независимо от числа степеней свободы. Поэтому на одну степень свободы поступательного движения приходится:
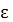 1
1 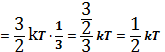 (2)
(2)
Согласно закону Больцмана о равномерном распределении энергии по степеням свободы молекул, находящихся в термодинамическом равновесии, на каждую поступательную и вращательную степень свободы приходится энергия равная:
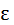 пост.вращ.=
пост.вращ.= 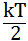
а на каждую колебательную степень свободы в среднем
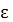 кол=kT,
кол=kT,
т.е. в два раза больше, т.к. колебательная степень свободы iкол не только 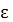 кин, но и
кин, но и 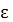 потенц. Причем
потенц. Причем 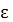 кин и
кин и 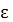 потенц. равны между собой.
потенц. равны между собой.
Таким образом, средняя энергия молекулы равна:
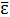 =
= 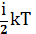 (3)
(3)
где i=iпост+iвращ+2iколеб (4)
С учетом выше сказанного внутренняя энергия 1 моля идеального газа Um равна:
Um=( ∙NA=
∙NA=  , (kNA=R) (5)
, (kNA=R) (5)
Для произвольной массы
PV= 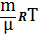 (ур-е Клапейрона-Менделеева)
(ур-е Клапейрона-Менделеева)
U= 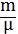 ∙
∙ 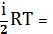 ν
ν  (6)
(6)
Значение U можно менять 2-мя способами:
1) Совершая работу над системой (сжимать газ) (Поршень, цилиндр)
2) Сообщая тепло газу (нагревая) в процессе обмена внутренними энергиями соприкасаемых тел с разными Т.
Т.е. есть две формы передачи энергии от одних тел другим:
- работа
- теплопередача
В первом случае механическая работа (энергия) превращается в тепловую.
Во втором случае наоборот, тепловая энергия превращается в механическую работу. Т.е. наблюдается взаимное превращение энергии одного вида в энергию другого вида. При этом превращении соблюдается закон сохранения и превращения энергии.
Первый закон термодинамики указывает на то, что при любом способе перехода системы из первого состояния во второе, изменение внутренней энергии 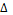 U=U2-U1 будет одинаковым и равным разности между теплом Q, переданным системе, и работой A, совершаемой системой против внешних сил:
U=U2-U1 будет одинаковым и равным разности между теплом Q, переданным системе, и работой A, совершаемой системой против внешних сил:
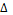 U=Q-A (6)
U=Q-A (6)
Q= 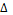 U+A (7)
U+A (7)
– первое начало термодинамики.
Дифференциальная форма:
dQ=dU+dA (8)
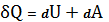 (9)
(9)
dU - малое изменение внутренней энергии
 A – элементарная работа
A – элементарная работа
 - бесконечно малое количество теплоты
- бесконечно малое количество теплоты
3. Работа газа при изменении его объема
Вспомним, что:
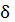 A=Fdl cosα. При α=0 cosα=1.
A=Fdl cosα. При α=0 cosα=1.
С другой стороны,
P= 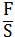 ; → F=PS
; → F=PS
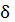 A=PSdl=PdV (10)
A=PSdl=PdV (10)
Полная работа:
A= 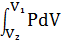 (11)
(11)
Формула (11) справедлива при любых изменениях V твердых, жидких и газообразных молекул.
Работу, произведенную при любом процессе, можно изобразить графически:
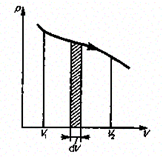
Рис. 2.
Рис. 2 характерен только для равновесных процессов. Равновесными называются процессы, состоящие из последовательности равновесных состояний. Медленные процессы близки к равновесным.
 2021-09-14
2021-09-14 431
431








