Метод комплексообразования основан на том, что вещество, содержа-щееся в титранте, образует с анализируемым катионом прочное комплексное соединение, растворимое в воде. Связывание определяемого иона в комплекс
тем полнее, чем прочнее этот комплекс, т.е. чем больше константа его устой-чивости (β).
Для анализа широко применяют группу органических реактивов, назы-ваемых комплексонами.
Хотя число различных комплексонов в настоящее время составляет не одну сотню, под термином «комплексонометрия» обычно имеются в виду ре-акции титрования солями этилендиаминтетрауксусной кислоты, чаще всего двухзамещенной натриевой солью Na2H2Y·2H2O, называемой трилоном Б (ЭДТА).
Реакции взаимодействия ЭДТА с катионами металлов протекает по уравнениям:
Ca2+ + H2Y2- = CaY2- + 2H+
Zr4+ + H2Y2- = ZrY + 2H+
Как видно, независимо от заряда катиона в реакции комплексообразова-ния принимает участие один анион и происходит выделение двух ионов водо-рода.
Молярные массы эквивалента титранта и определяемого катиона равны их молярным массам.
При комплексообразовании ион металла замещает ион водорода в кар-боксильных группах и связывается координационно с атомами азота. Напри-мер, комплексная соль магния с ЭДТА имеет строение:
CH3COONa
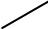
N  CH3COO
CH3COO
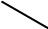

 CH2
CH2
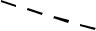
 Mg
Mg

 CH2
CH2
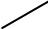

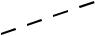 N
N 
 CH3COO
CH3COO
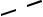
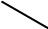 CH3COONa
CH3COONa
Степень протекания реакции катионов с комплексонами зависит от рН раствора, особенно это заметно при титровании катионов, образующихся сравнительно малоустойчивые комплексы (Mg2+, Ca2+ и др).
В качестве индикаторов используют металлоиндикаторы. Это индика-торы, изменение окраски которых, зависит от концентрации иона металла. Они образуют с ионами титруемого металла окрашенные комплексы.
Металлоиндикаторы делят на две группы. К первой группе относятсяиндикаторы, не имеющие собственной окраски, но образуют с ионами ме-таллов окрашенные комплексы. Например, при титровании Fe (III) использу-ют салициловую кислоту, тайрон и другие. Однако интенсивность окраски та-ких комплексов обычно невысока.
Ко второй, наиболее многочисленной группе металлоиндикаторов, от-носят органические соединения, содержащие в своих молекулах хромофорные (окрашенные) группы, образующие с ионами металла внутрикомплексные со-единения, по цвету отличающиеся от самих индикаторов. Эти индикаторыназывают металлохромными.
К металлоиндикаторам предъявляют ряд требований:
-образовывать с ионами металлов устойчивые комплексы. Условные константы устойчивости комплекса МInd должны быть меньше констант устойчивости комплексов данного металла с ЭДТА;
-комплекс иона металла с индикатором должен быстро разрушаться при действии ЭДТА (<10с.);
-изменение в ТЭ должно быть контрастным.
Метод комплексонометрии применяется для определения как отдель-ных ионов, так и групп ионов.
Если условия титрования ионов, присутствующих в растворе, суще-ственно отличаются друг от друга (разность логарифмов условных констант
устойчивости β различных металловDlgb =lgb¢M1Y-lgb¢M2Y отличаются более
чем на 4 единицы), можно последовательно определить несколько элементов
в растворе, меняя величину рН.
Селективност ь комплексонометрического титрования повышают пу-тем разделения или маскирования мешающих компонентов.
Для раздельного определения ионов используют следующие виды
м а с к и р о в к и:
1. Создание в растворе соответствующего рН
Наиболее простой способ маскирования заключается в установлении соответствующей кислотности титруемого раствора. Например, ионы железа (III), циркония (IV), тория (IV) титруют в кислой среде при рН 2, и двухзаряд-ные ионы при этом практически не мешают. На рис. 9.30 показано, при каком минимальном значении рН можно удовлетворительно оттитровать различные ионы металлов.
2. Комплексообразование с посторонним комплексообразователем.
Широко используется маскирование путем комплексообразования с по-сторонним комплексообразующим реагентом.
| Таблица 9 | |||
| Маскирование с помощью комплексообразующих реагентов при титровании неко- | |||
| торых ионов металлов раствором ЭДТА | |||
| Определяе- | Металлоиндикатор | Маскирующие ве- | Ионы, не мешающие опреде- |
| мый ион ме- | щества | лению | |
| талла | |||
| Zn (П), | 1-(2-Пиридилазо)- | Фторид-ион, рН5– | Ca(II),Mg(II), Mn(II), Fe(III), Sn |
| Cd (II) | 2- нафтол | (IV), Th (IV) | |
| Ga(III) | Тоже | N-Метилгли-цин- | Cd(II),Al(III), In (III), Bi (III) |
| дитиокарбаминат, | |||
| рН 2–3 | |||
| In(III) | » | Цианид-ион, | Сu(II), Ni(II), Со(II), Zn(II),Cd |
| рН7–8 | (II), Fe (III) | ||
К таким относятся, например, фторид-, пирофосфат-, тартрат-, цитрат-ионы, тиомочевина, триэтаноламин и др. Некоторые примеры такого маски-рования приведены в табл. 9.
3. Изменение степени окисления определяемого или мешающего компо-нента
Маскировать можно также изменением степени окисления определяе-мого или мешающего элемента.
| Индикаторы, используемые в комплексонометриии | Таблица10 | |||
| Ион | Индикатор | рНопт | Изменение окраски | |
| Mg2+ | Ксиленоловый оранжевый | 11,5–12,5 | Фиолетовая–серая | |
| Эриохромовый черный Т | Винно-красная–синяя | |||
| Ca2+ | Крезолфталексон | 10–11 | Пурпурная–розовая | |
| Мурексид | 12–13 | Красная–сине-фиолетовая | ||
| Cu2+ | 1-(2-Пиридилазо)-2-нафтол | Фиолетовая–желтая | ||
| Пирокатехиновый фиолетовый | 5,5–6,5 | Синяя–желтая | ||
| Fe3+ | Ксиленоловый оранжевый | 1–2 | Красно-фиолетовая–желтая | |
| Пирокатехиновый фиолетовый | 2–3 | Синяя–желтая | ||
| Тайрон | 2–3 | |||

Например, молибден (VI) и вольфрам (VI) образуют комплексы с ЭДТА, не используемые в титриметрии из-за их малой устойчивости. Высо-коселективное определение вольфрама и молибдена основано на титровании суммы всех элементов с предварительным восстановлением молибдена и вольфрама до степени окисления +5 и на титровании всех элементов, кроме молибдена и вольфрама, без их восстановления. В кислой среде при рН 2–3 можно проводить титрование тория, скандия, галлия и других ионов в при-сутствии железа (III), если железо маскировать восстановлением до степени окисления +2.
Виды титрования. В комлексонометрии при определении концентра-ции анализируемых веществ применяют прямое, обратное, вытеснительное и косвенное титрование.
Обратное титрование основано на добавлении избыточного количества ЭДТА и последующем титровании избытка. Применяют его в тех случаях, когда реакции образования комплекса с ЭДТА протекают медленно или нет подходящего металлоиндикатора для определения конечной точки титрова-ния. Способ обратного титрования наиболее удобен при определении ионов металлов в присутствии анионов, образующих с определяемыми ионами ме-талла малорастворимые соединения. Например, можно определить свинец в присутствии сульфат-ионов, магний в присутствии фосфат-ионов и др. При-сутствие ЭДТА препятствует образованию осадков.
Вытеснительное титрование основано на реакции, при которой опреде-ляемый ион металла М1n+ вытесняет ион металла М2n+ из его менее устойчи-вого комплекса с ЭДТА. Например, определение ионов бария проводят путем вытеснения цинка (II) из комплексов с ЭДТА в аммиачном буферном раство-ре с рН≥10.
 2021-09-15
2021-09-15 218
218








