Э Л Е К Т Р О Х И М И Я
2. Коррозия металлов.
3. Электролиз.
Электрохимия - это раздел химии, который|какой| изучает взаимные превращения|преобразование| химической и электрической энергий.
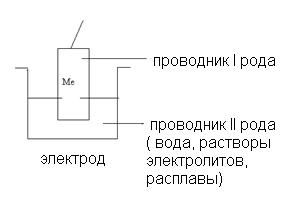
1. Электрод – это система, которая состоит из проводника I рода (металл, графит.), погруженного в проводник ІІ рода (раствор или расплав электролита).
2. Электродный процесс – это процесс, который происходит на границе: проводник I рода – проводник ІІ рода.
3. Анод – электрод, на котором происходит процесс окисления (отдача электронов).
4. Катод – электрод, на котором происходит процесс восстановления (присоединение электронов).
5. Электродный потенциал – энергия, которая выделяется или поглощается в ходе электродных процессов (φ, В).
Ме0 → Меn+ + ne, φок. процесс
 окисления
окисления
Men+ + ne → Me0, φвосст. процесс
восстановление
φвосст., Me0 ↔ Меn+ + ne, φок.
φвосст. = - φок.
Если электродные процессы происходят при стандартих условиях, то потенциалы называются стандартными φ0, В
Стандартные условия: Т = 298К, Р = 1,01• 105 Па, СМ = 1 моль / л
Таблица значений стандартных электродных потенциалов восстановления (Меn+) позволяет определить:
1. Сравнительную электрохимическую активность металлов: чем меньше значение потенциала восстановления|восстановления| иона, тем активнее металл.
2. Способность металлов вытеснять другие металлы из|с| растворов их солей: каждый предыдущий|предварительный| вытесняет все последующие.
3. Способность металлов вытеснять водород из кислот – неокислителей (HCl, HBr, HI, H2SO4(разб.), и тому подобное): если значение потенциала < 0 (то есть отрицательное) – то вытесняет.
Значения электродных потенциалов зависят от: температуры, концентрации электролита, давления (для газовых систем). Зависимость выражена в уравнении Нернста (Вальтер Нернст 1864 – 1941, нем.)
φ = φ0 + RT ∕ nF ∙ ln [Men+],
φ – электродный потенциал при условиях, отличающихся от стандартных; φ0- стандартный электродный потенциал R – универсальная газовая постоянная T – абсолютная температура n – число электронов, которые принимают участие в процессе F – число Фарадея (F = 96500Кл / моль) ln [Men+]– натуральный логарифм концентрации катионов металла в электролите
Для вычисления|исчисления| потенциалов при условиях, отличающихся от стандартных только концентрацией электролита, используют приведенное|сводит| уравнение Нернста:
φ = φ0 + 0,059 ∕ n ∙ lg [Men+]
Г А Л Ь В А Н И Ч Е С К И Е Е Л Е М Е Н Т И –
это системы, которые состоят из двух электродов, |какие| имеющих разные|различные| потенциалы и соединенные внешней и внутренней цепью.
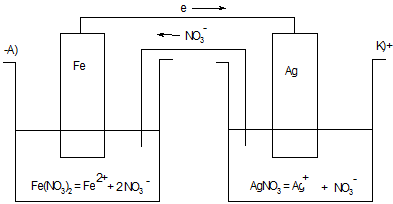
Анодом в таких системах будет тот из двух металлов, который имеет меньшее значение электродного потенциала восстановления иона φ Меn+∕ Ме0, В. На аноде всегда происходит процесс окисления, который сопровождается образованием свободных электронов. Анод имеет знак (-). От анода электроны двигаются к катоду, где принимают участие в процессе восстановления ионов из электролита. Катод имеет знак (+).
Сила, которая двигает электроны от аноду к катоду называется электродвижущей силой (ЭДС, В). Она тем больше, чем больше разница значений электродных потенциалов анода и катода.
 2014-02-13
2014-02-13 5405
5405







