Твердые вещества, при растворении которых в воде и других полярных растворителях образуются электролиты, являются, как правило, кристаллическими телами, имеющими ионные или близкие к ионным решётки. В чисто ионных решётках не существует молекул вещества. Ионы противоположных знаков, составляющие такую решётку, связаны между собой большими электростатическими силами. При переходе ионов в раствор энергии электростатического взаимодействия ионов в решётке противопоставляется энергия взаимодействия ионов с дипольными молекулами растворителя, который втягивает ионы решётки в раствор. При этом ионы окружаются молекулами растворителя, образующими вокруг иона сольватную (в частном случае - гидратную) оболочку. Энергия взаимодействия ионов различных знаков, перешедших в раствор и окружённых сольватными оболочками, уменьшается по сравнению с энергией их взаимодействия в решётке обратно пропорционально диэлектрической проницаемости растворителя D в соответствии с законом Кулона:
E = - 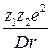
где z1 и z2 - число элементарных зарядов катиона и аниона; r - расстояние между катионом и анионом.
Если энергия взаимодействия ионов с растворителем становится соизмеримой с энергией ионов в кристаллической решётке, то происходит растворение с диссоциацией.
Надо помнить при этом, что при растворении должен уменьшиться изобарный потенциал G системы, а внутренняя энергия (и энтальпия) может как уменьшаться, так и увеличиваться (отрицательная и положительная теплоты растворения).
Взаимодействие дипольных молекул растворителя с элементами кристаллической решётки может привести к образованию электролита даже при растворении веществ, имеющих молекулярную решётку, решётку промежуточного типа или находящихся в газообразном состоянии (атомы в молекулах газа связаны ковалентно).
Ясно, что для осуществления электролитической диссоциации определяющую роль играет взаимодействие ионов с растворителем (в водных растворах - гидратация, в общем случае - сольватация). На важное значение гидратации ионов впервые указали И.А.Каблуков и В.А.Кистяковский. Они положили начало развитию теории электролитов в направлении, которое указывал Д.И.Менделеев, то есть объединили так называемую сольватную теорию и физическую теорию Вант-Гоффа - Аррениуса.
Связь между диэлектрической проницаемостью D растворителя и его способностью образовывать растворы, проводящие электрический ток, отмечалась давно. Вода, диэлектрическая проницаемость которой D = 81 при 18°C, а также HCN (D=107 при 25°C) и HCOOH (D=57 при 25°С) принадлежат к растворителям, вызывающим сильную диссоциацию. Низшие спирты и кетоны, уксусная кислота, пиридин имеют диэлектрические проницаемости в пределах 20-35 и также способны образовывать электролиты, хотя и в меньшей степени, чем вода.
Кроме величины диэлектрической проницаемости важное значение имеет взаимодействие молекул растворителя с молекулами растворённого вещества. Это взаимодействие нередко приводит к образованию новых молекул или молекулярных комплексов, которые в данном растворителе способны диссоциировать на ионы.
Лекция 41
 2014-02-13
2014-02-13 1634
1634








