Электропроводность (удельная и эквивалентная), ее зависимость от концентрации и температуры. Методы измерения электропроводности.
Электропроводность К - величина, обратная электрическому сопротивлению R. Так как R = r  , то К =
, то К = 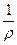 ×
× 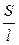 = k
= k 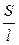

где r - удельное электрическое сопротивление; l - расстояние между электродами; S - площадь электрода; k - удельная электропроводность.
Удельная электропроводность k жидкости - это электропроводность одного кубического сантиметра раствора, заполняющего пространство между плоскими электродами одинаковой, очень большой площади, находящимися на расстоянии 1 см. Кубический сантиметр раствора должен находиться вдали от границ электрода. [k] = Ом-1× см-1.
По закону Ома: R = U/I; U = E× l (Е - напряженность поля, или падение напряжения на 1 см расстояния; l - расстояние между электродами); I = i × S (i - плотность тока, или ток, приходящийся на 1 см2 поверхности электрода; S - площадь электрода). Тогда:
k 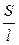
 =
= 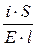 ; i = k× E
; i = k× E
При Е = 1 В/см i = k.
I = 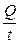 ; i =
; i = 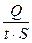
Таким образом, k - это количество электричества, которое проходит в единицу времени через единицу поперечного сечения проводника при напряженности электрического поля 1 В/см.
Кривая зависимости удельной электропроводности растворов от концентрации обычно имеет максимум (четко выраженный для сильных электролитов и сглаженный для слабых). Наличие максимумов на кривых k - с можно объяснить следующим образом. В разбавленных растворах сильных электролитов (a = 1) электропроводность растет пропорционально числу ионов, которое, в свою очередь, растет с концентрацией. В концентрированных растворах сильных электролитов ионная атмосфера существенно уменьшает скорость движения ионов, и электропроводность падает. В слабых электролитах плотность ионной атмосферы мала и скорость движения ионов мало зависит от концентрации, однако с увеличением концентрации раствора заметно уменьшается степень диссоциации, что приводит к уменьшению концентрации ионов и падению электропроводности.
Удельная электропроводность зависит от температуры. Зависимость дается эмпирическим уравнением:
kt = k18 × [1 + a (t - 18)]
a - температурный коэффициент электропроводности; k18 (k25) - стандартное значение.
слабый эл-т
Зависимость удельной электропроводности от концентрации электролита |   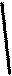   l сильный эл-т слабый эл-т С Зависимость эквивалентной электропроводности от концентрации электролита l сильный эл-т слабый эл-т С Зависимость эквивалентной электропроводности от концентрации электролита |
Эквивалентная электропроводность l [в см2/(г-экв×Ом)] - это электропроводность такого объема (j см3) раствора, в котором содержится 1 г-экв растворенного вещества, причем электроды находятся на расстоянии 1 см друг от друга.
Найдем связь между k и l. Представим себе погруженные в раствор параллельные электроды на расстоянии 1 см, имеющие весьма большую площадь. Электропроводность раствора, заключенного между поверхностями таких электродов, имеющими площадь, равную j см2, и есть эквивалентная электропроводность раствора. Объем раствора между этими площадями электродов равен j см3 и содержит 1 г-экв соли. Величина j, равная 1000/с см3/г-экв, называется разведением. Таким образом:
l = k× j; l = 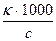
Мольная электропроводность электролита - это произведение эквивалентной электропроводности на число грамм-эквивалентов в 1 моль диссоциирующего вещества.
Зависимость эквивалентной электропроводности от концентрации:
1. Зависимость l - с: с увеличением с величина l уменьшается сначала резко, а затем более плавно.
2. Зависимость l - 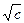 : для сильных электролитов соблюдается медленное линейное уменьшение l с увеличением
: для сильных электролитов соблюдается медленное линейное уменьшение l с увеличением 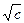 , что соответствует эмпирической формуле Кольрауша:
, что соответствует эмпирической формуле Кольрауша:
l = l¥ - А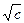
l¥ - предельная эквивалентная электропроводность при бесконечном разведении: с ® 0, j ® ¥.
3. Зависимость l - j: значение l сильных электролитов растет с увеличением j и асимптотически приближается к l¥. Для слабых электролитов значение l также растет с увеличением j, но приближение к пределу и величину предела в большинстве случаев практически нельзя установить.
 l l  сильный эл-т сильный эл-т
слабый эл-т
|  l сильный эл-т l сильный эл-т 
слабый эл-т
|
Все вышесказанное касалось электропроводности водных растворов. Для электролитов с другими растворителями рассмотренные закономерности сохраняются, но имеются и отступления от них, например, на кривых l - с часто наблюдается минимум (аномальная электропроводность).
Способы измерения электропроводности - самостоятельно.
 2014-02-13
2014-02-13 1886
1886


 k сильный эл-т
k сильный эл-т

 С
С