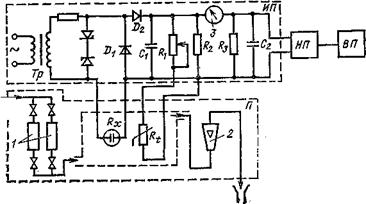
 Принципиальная измерительная схема кондуктомера АК-310.
Принципиальная измерительная схема кондуктомера АК-310.
К числу распространенных анализаторов жидкости относятся кондуктометры серии КК, которые содержат как двух- и четырехэлектродные преобразователи, так и безэлектродные. Приборами этой серии можно производить измерения электропроводности от 10–6 до 1 См/см при диапазоне рабочих температур 25±15°С и предельной основной погрешности ±2,5 %.
К числу наиболее существенных недостатков электродных кондуктомет-юв относятся рассмотренная выше поляризация и загрязнение электродов продуктами электрохимических реакций, протекающих на их поверхности, а также веществами, находящимися в растворах. Последнее вызывает необходимость их периодической механической или химической очистки и отмывки.
3.4. Безэлектродные кондуктометры.
Безэлектродные преобразователи, как говорит их название, содержат первичные преобразователи, не имеющие непосредственного контакта с измеряемой средой и свободные в связи с этим от таких недостатков, как поляризация электродов и их загрязнение.
Различают две разновидности безэлектродных кондуктометров: высокочастотные и низкочастотные.
В первых, работающих на частотах более 1 кГц, измерение концентрации анализируемого раствора производится путем контроля зависящего от нее реактивного сопротивления раствора.
Первичные преобразователи высокочастотных безэлектродных кондуктометров в зависимости от вида измеряемого реактивного сопротивления разделяются на емкостные и индуктивные. Схема преобразователей обоих видов представлена на рис. Поскольку между концентрацией раствора и выходными величинами преобразователей СХ и LХ существует сложная зависимость, на которую влияют помимо природы раствора геометрия и материал преобразователя, частота питания и др., их градуировочные характеристики определяются экспериментально для конкретного преобразователя и раствора.
В качестве измерительных преобразователей высокочастотных кондуктометров используются мостовые и резонансные схемы, питаемые от генераторов высокой частоты. В последних схемах измеряется частота собственных колебаний резонансного контура, зависящая от индуктивного или емкостного сопротивления первичного преобразователя.
В низкочастотных безэлектродных кондуктометрах анализируемый раствор протекает по трубе, образующей замкнутый виток. Последний подобен проводнику, в котором от первичной обмотки трансформатора наводится ЭДС, а протекающий ток зависит от электропроводности раствора. Низкочастотные кондуктометры используются для измерения значительных электропроводностей растворов.
В кондуктометрах серии КК измерение электропроводности от 10–2 до 1 См/см осуществляется безэлектродными кондуктометрами КК-8, КК-9, включающими в себя первичные преобразователи погружного и проточного типов. Схема такого кондуктометра представлена на рис. Первичный преобразователь представляет собой кольцевую пластмассовую трубу 1, по которой протекает анализируемый раствор. Эта труба с электропроводящей жидкостью представляет собой вторичный виток трансформатора Tp1, в котором наводится электродвижущая сила. Протекающий по контуру ток IЖ зависит от электропроводности раствора:
IЖ = E / RX = E k / К
где К – постоянная преобразователя, см-1.
Для измерительного трансформатора Тр2 виток 1 является первичным и создаст в сердечнике Тр2 магнитный поток ФЖ, пропорциональный току, протекающему в витке. Таким образом, в этом первичном преобразователе, как и в высокочастотных, отсутствуют электроды, контактирующие с анализируемой средой.
 Схема безэлектродного низкочастотного кондуктомера.
Схема безэлектродного низкочастотного кондуктомера.
В кондуктометре используется компенсационный метод измерения. Магнитный поток ФЖ, создаваемый жидкостным витком 1, компенсируется потоком ФК, создаваемым обмоткой ω2 трансформатора Тр2. Ток в этой обмотке изменяется при перемещении движка реохорда R, изменяющего напряжение, подаваемое в цепь компенсации. Обмотка ω2 и обмотка возбуждения ω3 имеют общее питание, что снижает влияние колебаний напряжения питания на показания прибора. Ток в обмотке ω2 зависит не только от положения движка реохорда, но и от сопротивления полупроводникового терморезистора Rt, ocyществляющего температурную компенсацию. Результирующий магнитный поток в магнитопроводе трансформатора Тр2, равный разности магнитных потоков, создаваемых жидким контуром и компенсационной обмоткой ω2, наводит в измерительной обмотке ω1 ЭДС, которая подается на вход усилителя. Равновесие измерительной схемы, которому соответствует ΔU = 0, имеет место при компенсации магнитных потоков, которое сохраняется при изменении температуры раствора.
Поверка кондуктометров.
При выпуске, ремонте и эксплуатации кондуктометров необходимо производить проверку правильности их показаний. Может производиться поверка измерительного преобразователя без электродного первичного преобразователя с помощью образцового магазина сопротивлений. Поверка показаний всего комплекта выполняется либо по методу непосредственного сличентя показаний поверяемого кондуктометра с образцовым при измерении электропроводности контрольных растворов, либо по методу прямого измерения поверяемым кондуктометром удельной лектропроводности стандартных растворов, имеющих электропроводность вблизи 20, 50, 80 % диапазона измерения. Контрольные растворы удельной электрической проводимости готовят весовым методом или разбавлением. Для их приготовления используют растворы: водный серной кислоты, водный хлористого калия, хлористого калия в этиленгликоле.
3.5. Потенциометрический метод анализа. Теоретические основы.
В практике анализа растворов значительное место занимают потенциометрические анализаторы, предназначенные для избирательного измерения активной концентрации определяемых ионов, в связи с чем их называют иономерами. Потенциометрический метод измерения базируется на законе Нернста, который был открыт для металлических электродов, а позднее распространен на электроды других веществ. Сущность рассматриваемого явления состоит в том, что при погружении металлического электрода в раствор на его поверхности возникает потенциал, зависящий от активной концентрации ионов этого металла в растворе. Возникновение потенциала обусловлено переходом ионов металла в раствор. В состоянии равновесия поверхностный потенциал обеспечивает выравнивание скоростей анодного и катодного процессов, связанных с переходом ионов металла в раствор и из раствора в электрод. Измерение поверхностного потенциала электрода позволяет судить о концентрации соответствующих ионов в растворе.
Уравнение Нернста, устанавливающее связь между равновесным потенциалом Е на поверхности электрода и активной концентрацией соответствующих ионов в растворе а, имеет следующий вид:
E = E0 + RT (ln a) / nF,
где Е0 – нормальный потенциал; R – газовая постоянная; Т – абсолютная температура; n – заряд ионов; F – число Фарадея.
Для измерения равновесного поверхностного потенциала Е необходимо замкнуть электрическую цепь, вводя в раствор второй электрод, называемый вспомогательным или электродом сравнения. Потенциал этого электрода в процессе измерения должен оставаться постоянным. Для характеристики потенциалообразующих свойств различных веществ значения равновесных потенциалов определяются по отношению к вспомогательному платиновому водородному электроду, принятому в качестве нормального. Этот электрод представляет собой платиновую пластину, погруженную в раствор с активной концентрацией ионов водорода, равной единице, при давлении водородного газа 0,1 МПа и температуре 298 К. Равновесные потенциалы электродов Е0, определенные при их погружении в соответствующие одно-нормальные растворы по отношению к нормальному водородному электроду, являются измеренными по так называемой водородной шкале и считаются нормальными. Нормальные потенциалы для некоторых видов веществ приведены в таблице.
Таблица. Нормальные электродные потенциалы, определенные по водородной шкале.
| Электрод | Потенциал, В | Электрод | Потенциал, В |
| Li+ / Li | –3,045 | Cu2+ / Cu | +0,337 |
| K+ / K | –2,925 | Ag+ / Ag | +0,799 |
| Ca2+ / Ca | –2,866 | Hg2+ / Hg | +0,845 |
| Na+ / Na | –2,714 | Pt2+ / Pt | +0,91 |
| Al3+ / Al | –1,662 | Cl– / Cl2, Pt | +1,3595 |
| Fe2+ / Fe | –0,4402 | Au3+ / Au | +1,498 |
В табл. знак минус стоит у потенциалов веществ, которые в ряду активностей стоят за водородом. В- графе "электрод" указаны потенциалообразующие ионы и за чертой – материал рабочего электрода.
В настоящее время область применения потенциометрических методов измерения расширяется благодаря созданию ионоселективных электродов, обладающих специфическими функциями по отношению к таким катионам и анионам, как Na+, К+, Са2+, РЬ2+, С1–, Вr–, I– и др. Этот метод используется также для измерения окислительно-восстановительного потенциала, характеризующего отношение активностей окисленной и восстановленной форм ионов в растворе. Вспомогательный электрод в этом случае является нейтральным, а на рабочем электроде развивается потенциал, при котором устанавливается динамическое равновесие между скоростями перехода электронов от восстановленной формы ионов к электроду и от электрода к окисленной форме ионов:
Е = Е0 + 0,058 [lg (a0Х/aRd)] / n,
где а0Х, aRd – активности соответственно окисленной и восстановленной форм ионов; n – число электронов, участвующих в реакции; Е0 – нормальный окислительно-восстановительный потенциал системы при aQХ/aRd = 1.
Приборы, предназначенные для измерения окислительно-восстановительного потенциала, называются редоксметрическими анализаторами.
Активная концентрация ионов в растворах обычно выражается в единицах десятичного логарифма. Так, рН = – lgaH+> pNa = – lgaNa+ в связи с этим измерительные приборы получили соответственно название рН-метров, pNa-метров и т. д. Наиболее широко потенциометрические приборы применяются для измерения активной концентрации ионов водорода. Их использование осуществляется в двух направлениях, связанных с измерением щелочных или кислотных функций раствора и определением момента нейтрализации растворов при их титровании.
Чистая вода представляет собой нейтральное вещество, слабо диссоциирующее с образованием ионов водорода Н+ и гидроксила ОН–. При температуре 22 °С константа диссоциации воды определяется выражением Kн2о = аH+aOH–= 10–14, откуда аH+ = aOH–= 10–7,рН = 7.
При растворении в воде кислот повышается концентрация ионов водорода, а рН снижается. При растворении щелочи концентрация ионов водорода снижается, а рН растет. Таким образом, отклонение числа рН в водных растворах от 7 в ту или другую сторону характеризует меру их кислотных или щелочных свойств. Следует отметить, что при повышении температуры чистой воды до 100 °С она приобретает кислые свойства, при этом число рН снижается до 6,12. При нулевой температуре вода обладает щелочными свойствами и рН=7,97. Для водных растворов диапазон изменения рН составляет 0–14, для такого растворителя, как аммиак, он достигает 0–32,7, а для муравьиной кислоты составляет 0–6,13.
Рабочие и вспомогательные электроды потенциометрических анализаторов.
Для получения поверхностного скачка потенциала, зависящего от активной концентрации соответствующих ионов в растворе, могут использоваться электроды трех типов. Электроды первого типа представляют собой либо металлы, либо металлы с сорбированным на поверхности газом, как, например, водородный электрод. Электроды второго типа являются системами, включающими в себя металлический контактный электрод, его плохо растворимую соль и раствор, содержащий анионы этой соли. Активная концентрация последних определяет величину электродного потенциала. К третьему типу относятся электроды специального назначения, имеющие более сложное устройство, такие, например, как электроды с жидкостными мембранами. Следует отметить, что электроды из чистых металлов в растворах быстро покрываются слоем окисной пленки и других химических соединений, что приводит к изменению характеристик электрода и потере специфических функций.
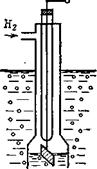 Схема водородного электрода.
Схема водородного электрода.
В качестве образцового электрода для измерения числа рН растворов используются водородные электроды (рис.). Электрод представляет собой платиновую пластинку, покрытую слоем платиновой черни, на поверхности которой хорошо сорбируется водород. Платиновая пластинка погружается в раствор, через который пропускается водород под давлением. При образовании первичного преобразователя (электродной системы) из двух водородных электродов, из которых вспомогательный является нормальным, при температуре 20 °С развивается Е = 0,058 рН, В. На границе раздела анализируемого раствора и раствора нормального электрода возникает диффузионный потенциал, вызывающий ошибку в измерении рН, достигающую 0,05 рН. Необходимость подачи в электрод водорода, отравление платины рядом химических веществ, присутствующих в растворах, обусловили их использование только в качестве образцовых, применяемых в лабораторной практике.
Для измерения числа рН в лабораторных и промышленных условиях используются стеклянные рабочие электроды, широкому распространению которых способствовала простота их устройства, высокие метрологические характеристики и широкий диапазон анализируемых сред. В стеклянных электродах водородными функциями обладает чувствительная тонкостенная мембрана, выполненная из литиевого или натриевого стекла. Согласно одной из наиболее распространенных теорий водородные функции мембраны обусловлены замещением ионов щелочных металлов, находящихся внутри силикатной решетки стекла, более подвижными ионами водорода. Замещение происходит до наступления равновесного состояния. Мембраны из литиевого стекла получили большее распространение вследствие их меньшей восприимчивости к катионам щелочных металлов в растворе, обладающих по сравнению с литием большими размерами ионов.
Принципиальная схема рабочего стеклянного электрода и его эквивалентная электрическая схема представлены на рис. Электрод выполнен из толстостенной стеклянной калиброванной трубки 1, к концу которой припаяна чувствительная мембрана из литиевого стекла 2. На внешней поверхности мембраны при погружении ее в раствор развивается потенциал Е3, зависящий от активной концентрации ионов водорода. Стеклянный электрод заполнен раствором кислоты постоянной концентрации 3, который замыкает электрическую цепь между мембраной и контактным электродом 4, соединенным с выводным проводом 5. Для обеспечения постоянства потенциала Е1, возникающего на поверхности контактного электрода 4, используется второй тип электрода, включающего металл, его плохо растворимую соль и раствор, содержащий анионы соли. Поскольку концентрация раствора внутри стеклянного электрода постоянна, потенциал Е1 согласно уравнению зависит только от температуры раствора. На внутренней поверхности чувствительной мембраны 2 развивается потенциал Е2, который при постоянной концентрации раствора 3, так же как Е1, зависит только от температуры. Чувствительная мембрана обладает асимметрией, которая проявляется в виде разности потенциалов на внешней и внутренней ее поверхностях при одинаковых активных концентрациях ионов водорода в растворах внутри и вне электрода.
Эквивалентная электрическая схема помимо рассмотренных выше ЭДС содержит активные сопротивления R1 и R2, из которых R1 соответствует сопротивлению раствора электролита внутри электрода, a R2 – сопротивлению чувствительной мембраны. Первое сопротивление ничтожно мало по сравнению с сопротивлением мембраны, достигающим 109 Ом. Это сопротивление зависит от температуры и снижается приблизительно в 2 раза при изменении температуры на каждые пять градусов.
В измерительной практике используются хлорсеребряные, бромсеребря-ные и каломельные стеклянные электроды. В первых двух электродах в качестве контактного используется серебряный электрод, покрытый слоем плохо растворимой соли хлористого или бромистого серебра (AgCl, AgBr), при этом электроды заполнены соответственно растворами 0,1н НС1 или 0,05н НВг. Внутри рабочего стеклянного каломельного электрода находятся ртуть, ее плохо растворимая соль Hg2Cl2 (каломель) и раствор 3,5н. КС1. Контактный электрод вводится внутрь ртути. Использование в каломельном электроде токсичный ртути ограничивает область его применения.
Крутизна водородной характеристики промышленных стеклянных электродов определяется уравнением (ГОСТ 16287-77)
St= – (54,197 + 0,1984t), мВ/рН. При температуре 20°С чувствительность составляет 58 мВ/рН, температурный коэффициент равен примерно 0,2 мВ/(°С-рН). Промышленные стеклянные электроды выпускаются в нескольких модификациях, отличающихся диапазоном измерения рН, областью температур и давлений анализируемой среды, верхние их значения составляют по температуре 150 °С, по давлению 1,2 МПа. Для того чтобы стеклянный электрод полностью приобрел водородные функции, его перед включением вымачивают в дистиллированной воде.
В качестве вспомогательных (сравнительных) электродов используют электроды второго типа – хлорсеребряные, реже – каломельные. Схема погружного непроточного вспомогательного хлорсеребряного электрода представлена на рис. Корпусом электрода служит толстостенная калиброванная трубка 1, внутри которой находится серебряный электрод 2, погруженный в 3,5н раствор КС1, содержащий кристаллы хлористого серебра 3. От анализируемого раствора внутренняя полость электрода изолирована резиновыми мембранами 4, в пространстве между которыми находится также 3,5н раствор КС1. Диффузионный потенциал на поверхности разделительной мембраны 4 достигает 12 мВ. Серебряный контактный электрод подключен к выводу 5. Общее сопротивление электрода не превышает 20 кОм, температурный коэффициент потенциала вспомогательного электрода составляет 0,25 мВ/°С. Непроточные электроды могут использоваться при давлении измеряемой среды до 0,025 МПа.
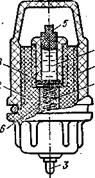 Схема выносного вспомогательного электрода.
Схема выносного вспомогательного электрода.
Для исключения влияния температуры анализируемого раствора на ЭДС вспомогательных электродов последние часто делают выносными с замыканием электрической цепи через электролитический ключ. Схема хлорсеребряного выносного вспомогательного электрода представлена на рис. Контактный серебряный электрод 1 помещен в пластмассовый корпус 2, в нижней части которого находится электрический вывод 3. Электрод показан с навинченной крышкой 4 и пробкой 5, которые используются при транспортировке и хранении электрода. При работе электрода они снимаются и электрод ввинчивается в дно резервуара с насыщенным раствором КС1. Серебряный электрод 1 окружен кристаллами хлористого серебра 6, которые для предотвращения диффузии отделены от насыщенного раствора КС1 7 пористой перегородкой 8. Вспомогательный электрод рассмотренной конструкции работает в цепях с переносом, работа которых сопровождается переходом электролита из одного раствора в другой.
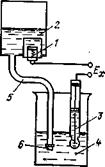 Схема электродной системы рН-метра с выносным вспомогательным электродом.
Схема электродной системы рН-метра с выносным вспомогательным электродом.
В электродной системе, схема которой представлена на рис., вспомогательный электрод 1 находится в резервуаре 2, заполненном насыщенным раствором КС1. Электрическая цепь между стеклянным электродом 3, погруженным в анализируемый раствор 4, и вспомогательным электродом 1 замыкается через раствор КС1, стекающий по резиновой трубке 5 в анализируемый раствор. На конце трубки 5 находится винт 6 с микропористой прокладкой, с помощью которых устанавливается медленный сток раствора, достигающий 15–30 мл/сутки. Трубка 5 с протоком раствора электролита называется "соляным мостиком" или "электролитическим ключом". Вытекание раствора КС1 исключает возможность проникновения посторонних ионов во вспомогательный электрод. Поскольку ионы К+ и С1– обладают близкими подвижностями, диффузионный потенциал, возникающий на границе двух растворов, незначителен. Выпускаемые модификации отечественных выносных электродов могут работать при давлении анализируемой среды до 0,6 МПа. Эквивалентная электрическая схема электродной системы кроме рассмотренных выше Е1–Е3, R1, R2 содержит ЭДС вспомогательного электрода, диффузионную разность потенциалов, суммарное сопротивление вспомогательного электрода и анализируемого раствора. Сопротивление вспомогательного электрода с электролитическим ключом составляет 2–5 кОм.
Общий вид градуировочной характеристики электродной системы рН-метра представлен на рис. Результирующая ЭДС, развиваемая электродной системой, зависит от числа рН раствора и его температуры. В точке И ЭДС не зависит от температуры, в связи с чем она называется изопотенциальной. В этой точке влияние температуры раствора на внешний Е3 и внутренние Е1, Е2 потенциалы стеклянного электрода взаимно скомпенсировано.
Выпускаемые отечественной промышленностью рабочие стеклянные и вспомогательные электроды стандартизованы (ГОСТ 16287-77, 16286-72). Для одной из промышленных электродных систем М033328, включающей в себя стеклянный рабочий электрод ЭСП-ОС-14 (3) и выносной вспомогательный насыщенный хлорсеребряный электрод, градуировочная характеристика определяется выражением
Е = – 33 – (54,197+0,1984tP) (рН – 3,28).
Для этой системы координаты изопотенциальной точки составляют
ЕИ = – 33 мВ, рНИ = 3,28.
У других электродных систем координаты изопотенциальной точки различаются, в связи с чем выбор систем должен производиться исходя из диапазона измеряемых значений рН.
Схема установки рН-метра с погружным преобразователем.
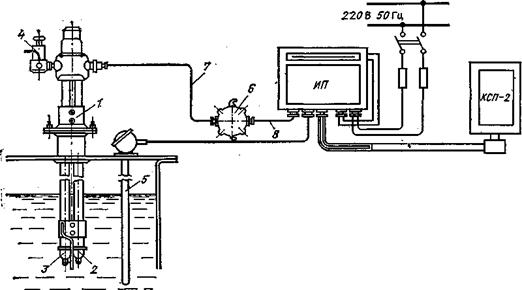 |
В промышленных рН-метрах электродная система снабжается дополнительной арматурой, обеспечивающей размещение электродов на технологических объектах, их контакт с измеряемой средой и защиту электродов от механических воздействий. Как и первичные преобразователи кондуктометров, электродные системы рН-метров выпускаются следующих типов: магистральные (ДМ), погружные (ДПг) и проточные (ДПр). Первые помещаются в трубопровод, по которому протекает анализируемая среда, вторые опускаются в резервуар, а через последние протекает анализируемый раствор из отбора, пройдя устройство подготовки пробы. Схема установки рН-метра с погружным первичным преобразователем (датчиком) ДПг, представлена на рис. Преобразователь 1 установлен на крышке резервуара. В анализируемый раствор погружены стеклянный электрод 2 и фторопластовая трубка 3, по которой раствор КСl стекает из бачка 4. В последнем находится вспомогательный выносной электрод. В анализируемый раствор погружен также медный термометр сопротивления 5.
Для подключения электродной системы к измерительному преобразователю ИП используется распределительная коробка 6, в которой с помощью специального разъема кабель электродов 7 соединяется с высокочастотным радиотехническим кабелем 8, идущим к измерительному преобразователю ИП. Глубина погружения электродов достигает 2 м, расстояние между первичным и измерительным преобразователями не превышает 150 м.
Измерительные преобразователи рН-метров.
Устройство приборов, предназначенных для измерения ЭДС электродной системы, определяется ее значительным внутренним сопротивлением и ограничением по величине протекающего через электроды тока, который для исключения поляризации электродов не должен превышать 10–12 А. Учитывая это требование, измерительные приборы должны иметь входное сопротивление не менее 1012 Ом. Таким сопротивлением обладают приборы с высокоомным входом, основанные на компенсационном методе измерения. Измерительные схемы различных преобразователей рН-метров имеют общие характерные черты, обусловленные видом градуировочных характеристик и их возможными отклонениями. Элементы измерительной схемы должны обеспечивать возможность введения ручной или автоматической температурной компенсации, допускать коррекцию параметров изопотенциальной точки рНИ, ЕИ и крутизны градуировочной характеристики. В изопотенциальной точке температурная компенсация должна отсутствовать. Общие приемы решения этих задач рассмотрим на примере измерительной схемы преобразователя с отрицательной обратной связью, представленной на рис.
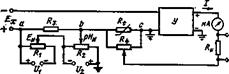 Принципиальная схема измерительного преобразователя рН-метра.
Принципиальная схема измерительного преобразователя рН-метра.
Сигнал от электродной системы ЕХ при большом коэффициенте усиления усилителя практически полностью компенсируется напряжением Uab и Ubc. Первое снимается с резистора R3, его величина зависит от положения движков переменных резисторов R1 и R2. Их взаимное смещение устанавливается таким, чтобы Uab равнялось ЕИ, компенсируя сигнал электродной системы в изопотенциальной точке. Сигнал отрицательной обратной связи снимается с цепи, включающей Rt переменный резистор R4, с помощью последнего производится настройка прибора при отклонениях крутизны градуировочной характеристики электродной системы. Медный резистор Rt погружен в анализируемый раствор и осуществляет температурную компенсацию. При увеличении температуры раствора возрастает ЕХ, но при этом также увеличивается Rt, благодаря чему при том же выходном токе обеспечивается соответствующее изменение сигнала компенсации Ubc.
В изопотенциальной точке ЕХ = ЕИ = –Uab и сигнал отрицательной обратной связи Ubc должен быть равен нулю при наличии тока на выходе усилителя У. Выполнение этого условия обеспечивает исключение влияния изменений Rt в изопотенциальной точке. Для компенсации в изопотенциальной точке выходного тока, протекающего через сопротивления R4 и Rt, используется встречно направленный ток, создаваемый между точками b и с источником стабилизированного напряжения U2. Таким образом, переменный резистор R2 служит для настройки на изопотенциальную точку рНИ. Относительно фиксированной точки b устанавливается движок резистора R1, обеспечивая настройку на потенциал ЕИ. Проверкой правильности настройки преобразователя на координаты изопотенциальной точки является отсутствие изменений выходного тока в изопотенциальной точке при изменении сопротивления Rt.
Усилители потенциометров и измерительных преобразователей, предназначенных для работы с электродными системами, отличаются высоким входным сопротивлением.
К числу наиболее распространенных отечественных рН-метров относятся приборы рН-201 и рН-261. Их измерительные преобразователи имеют выходные сигналы по постоянному напряжению 0–50 мВ и токовый 0–5 мА. Это обеспечивает возможность их работы в комплекте с автоматическими потенциометрами, устройствами регулирования и контроля, использующими унифицированный токовый сигнал. Прибор рН-201 имеет пять диапазонов измерения числа рН: 1; 2,5; 5; 10; 15, предельная допустимая погрешность составляет ±1 % диапазона измерения.
При выпуске и эксплуатации рТТ-метров производится как раздельная поверка электродов и измерительных преобразователей, так и комплектов рН-метров в целом. Для воспроизведения шкалы рН водных растворов в диапазоне температур от 0 до 150°С используются буферные растворы, представляющие собой растворы хорошо диссоциирующих солей слабых кислот и сохраняющих постоянство рН при разбавлении растворов водой и добавлении небольших количеств свободной кислоты или щелочи. (Например, 0,1 м раствор HCl.)
 2014-02-13
2014-02-13 1158
1158








