Основными признаками, положенными в основу классификации белков, являются их физико-химические свойства и форма молекул. По физико-химическим свойствам белки классифицируют на простые (протеины) и сложные (протеиды). Простыми называются такие белки, которые при гидролизе дают только АК. Сложные белки при гидролизе дают наряду с АК вещества небелковой природы (углеводы, липиды, фосфорную кислоту, нуклеиновые кислоты и др.). Небелковый компонент сложных белков получил название простетической группы. Однако классификация белков на простые и сложные условна. Например, простые белки гистоны могут подвергаться посттрансляционным модификациям (фосфорилированию, метилированию, ацетилированию и др.) и переходить в сложные белки.
В зависимости от формы или конформации белки делят на два основных класса – глобулярные и фибриллярные. Глобулярные имеют шарообразную, эллипсоидную или овальную форму молекул, т.е. их полипептидные цепи свернуты в плотную глобулу. Глобулярные белки растворимы в водных растворах. Фибриллярные состоят из параллельно расположенных полипептидных цепей, образуют вытянутую нитевидную молекулу, выполняют защитные или структурные функции. К ним относятся белки волос (кератин), шелка (фиброин), мышц (миозин). Основа структуры фибриллярного белка коллагена – тройные спирали, состоящие из трех полипептидных цепей. Фибриллярные белки имеют большую прочность, могут сжиматься и распрямляться, нерастворимы в воде и разбавленных солевых растворах (рисунок 5).
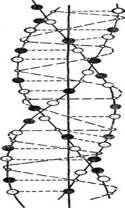
Рисунок 5 – Структура фибриллярного белка
Протеины классифицируют по растворимости в различных растворителях.
Альбумины хорошо растворяются в воде и солевых растворах. Высаливаются в растворе сульфата аммония в пределах насыщения 80-100 %. В альбуминах много аминокислоты лейцина (до 15 %), имеется также лизин, аспарагиновая и глутаминовая кислоты, в очень незначительных количествах – глицин. Альбумины содержатся в цитоплазме всех клеток, почти все ферменты семян находятся в альбуминовой фракции.
Глобулины растворяются в растворах нейтральных солей (10 % NаСl) и совершенно не растворяющимися в воде. Они полностью высаливаются раствором сульфата аммония в пределах насыщения 50 %. По химической природе глобулины близки к альбуминам, однако богаче глицином (до 3 %);ММ 100-300 тыс. Это главные белки семян бобовых (60-90 % всех белков) и масличных (50-60 % всех белков) культур. Среди глобулинов известны легумин и вицилин из семян гороха, фазеолин – фасоли, глицинии – сои, эдестин – конопли и др.
Глютелины не растворяются в воде, но растворяются в растворах разбавленных щелочей (0,2 %). Они содержатся в основном в семенах злаков, где их может быть 25-40 % от общего содержания белков, а в рисе – 60-70 %. Глютелины представляют собой смесь различных белков, из которой выделяют индивидуальные белки: глютелин – из зерна пшеницы (составляющий половину клейковины); оризенин – из зерна риса; глутелин – иззерна кукурузы и др.
Проламины – белки, растворимые в 70-80 % спирте, на чем основаны методы их выделения. Название связано с тем, что при их гидролизе образуется много пролина и аммиака. Проламины – это специфические белки злаков. Содержание их в зерне составляет 20-50 %. Молекулярная масса проламинов 26-40 тыс. Среди проламинов известны глиадин пшеницы и ржи, гордеин – овса и ячменя, зеин – кукурузы.
Протеиды – сложные белки, состоящие из простого белка и небелковой части (простетической группы). К сложным белкам относятся хромопротеиды, липопротеиды, гликопротеиды, нуклеопротеиды и т.д.
Хромопротеиды состоят из простого белка и окрашенной простетической группы. К ним относятся белки, связанные с хлорофиллом, каротиноидами, фитохромами, а также цитохромы, ферредоксин, пластоцианин. Хромопротеины участвуют в процессах фотосинтеза, дыхания, в различных окислительно-восстановительных реакциях. Простетическая группа некоторых хромопротеидов содержит металл.
В растениях содержится хромопротеид, состоящий из белка и хлорофилла. Детально изучена химическая структура, свойства и функции хлорофилла. В настоящее время известно два типа хлорофилла – хлорофилл а – C55H7208N4Mg и хлорофилл в – C55H70O6N4Mg. В основе строения хлорофилла лежит протопорфирин, который связан двумя основными и двумя дополнительными валентностями с атомом магния. Хлорофилл, являющийся сложным эфиром двухосновной кислоты и двух спиртов – метиловогои высокомолекулярного ненасыщенного спирта – фитола, содержится в хлоропластах в комплексе с белком и липоидами. Он играет исключительно важную роль в процессах фотосинтеза зеленых растений. Хромопротеиды, не содержащие в своем составе металлов, назваются флавопротеидами. В качестве простетической группы они содержат рибофлавин в составе флавинадениндинуклеотида (ФАД) или флавинмононуклеотида (ФМН), ковалентно связанного с апоферментом. Флавопротеиды играют важную роль в окислительно-восстановительных процессах. В окисленном состоянии флавиновые ферменты окрашены в красный, коричневый или зеленый цвет.
Липопротеиды – это группа сложных белков, содержащих в качестве простетической группы различные жироподобные вещества (фосфолипиды, гликолипиды, сульфолипиды, разнообразные стероиды и терпеноиды). Особым разнообразием липидных компонентов отличаются липопротеины мембран хлоропластов.
Гликопротеиды имеют в своем составе углеводы и их производные – глюкозу, маннозу, галактозу, глюкозамин, глюкуроновую кислоту и др. Сахар обычно связан с остатками серина, треонина, оксипролина или аспарагиновой кислоты. Примером гликопротеинов могут служить запасный белок бобовых – вицилин, ферменты – пероксидаза и глюкооксидаза, ядовитый белок рицин из семян клещевины. Рицин необратимо инактивирует рибосомы.
Нуклеопротеиды растений подобны таким же белкам животных. Они сходны по строению, свойствам и функциям. Это сложные белки, состоящие из простых белков и нуклеиновых кислот. Белковый компонент нуклеопротеидов обычно состоит из гистонов или протаминов. В зависимости от природы нуклеиновой кислоты различают два вида нуклеопротеидов. В состав рибонуклеопротеидов входит РНК, а в дезоксирибонуклеопротеидах содержится ДНК.
Заключениие. Основные функции белков в растительном организме: структурная, ферментативная, т ранспортная, запасная, защитная и т.д. Структурные единицы белковой молекулы – протеиногенные аминокислоты, содержащие различные R-группы – неполярные или гидрофобные; полярные (гидрофильные), но незараженные; отрицательно заряженные (кислые); положительно заряженные (основные). Ковалентные и нековалентные связи белковой молекулы. Имеется четыре уровня структуры белковой молекулы. Все уровни структуры взаимосвязаны, последовательность остатков аминокислот (первичная структура) полностью определяет конформацию белковой молекулы. Проявление биологической активности белков зависит от высших уровней их структурной организации.
 2014-02-17
2014-02-17 2271
2271
