Модульная единица 4. Аминокислоты, нуклеотиды и белки.
Лекция 2. Строение, свойства и биологические функции аминокислот, нуклеотидов, белков и витаминов.
Аннотация. В данной лекции даётся биохимическая характеристика протеи-ногенных и других аминокислот, пуриновых и пиримидиновых нуклеотидов, основных групп белков и витаминов. Раскрывается биологическая роль этих веществ в растительных и других организмах. Отмечается влияние белков, аминокислот и витаминов на качество растительной продукции. Даются сведения о содержании белков и витаминов в сельскохозяйственных растениях и получаемой из них растительной продукции.
Ключевые слова: протеиногенные аминокислоты, незаменимые аминокислоты, меланоидины, меланины, пуриновые нуклеотиды, пиримидиновые нуклеотиды, нуклеозиды, дифосфат- и трифосфатпроизводные нуклеотидов, полипептидная теория строения белков, первичная, вторичная, третичная и четвертичная структура белков, пептидная связь, гидрофобное ядро белковой молекулы, нативная конформация белковой молекулы, денатурация белков, фибриллярные и глобулярные формы белковых молекул, протеины, протеиды, альбумины, глобулины, проламины, глютелины, гликопротеиды, липопротеиды, нуклеопротеиды, гистоны, полноценные и неполноценные белки, биологическая ценность белков, водорастворимые и жирорастворимые витамины, провитамины, антивитамины.
|
|
|
Рассматриваемые вопросы:
1. Строение, свойства и биологические функции аминокислот.
2. Строение, свойства и биологические функции нуклеотидов.
3. Строение, свойства и биологические функции белков.
4. Строение, свойства и биологические функции витаминов.
Цели и задачи изучения модульной единицы. Изучить строение, свойства и биологические функции аминокислот, нуклеотидов, витаминов и основных групп белков. Научить студентов использовать сведения об аминокислотах, нуклеотидах, белках и витаминах при оценке качества растительной продукции.
Аминокислоты - это первичные азотистые вещества растений, которые синтезируются с использованием минерального азота, поступающего главным образом из почвы. В молекулах аминокислот имеются карбоксильные и аминные группировки, соединённые с органическим радикалом алифатической, ароматической или гетероциклической природы. Если аминокислота содержит одну карбоксильную и одну аминную группу, связанную со вторым углеродным атомом (α-положение), строение такой аминокислоты можно выразить следующей формулой:
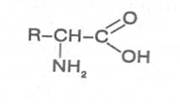
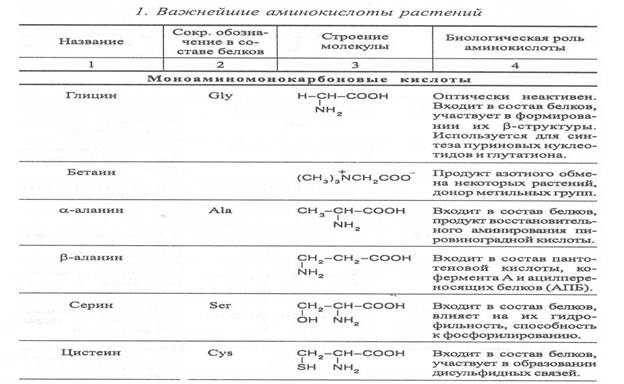
Аминокислоты, имеющие одну карбоксильную и одну аминную группу, принято называть моноамuномонокарбоновымu. У большинства из них аминогруппа находится в α-положении по отношению к атому углерода карбоксильной группы. Однако известны также некоторые аминокислоты, у которых аминогруппа связана с другими углеродными атомами (_b, γ, d и др., см. табл. 1).
|
|
|
В организмах также синтезируются аминокислоты с двумя карбоксильными или двумя аминными и другими азотсодержащими группировками. Аминокислоты, содержащие две карбоксильные и одну аминную группы, обычно называют моноамuнодuкaрбоновы.мu, а имеющие две аминные и одну карбоксильную - диаминомонокарбоновымu. Кроме того, аминокислоты различаются по строению радикала R, который может быть представлен неразветвлённой, а иногда и разветвлённой углеродной цепью, ароматическими и гетероциклическими производными.
Наряду с аминокислотами важную роль в обмене азотистых веществ играют некоторые иминокислоты (пролин, пипеколииовая кислота и др.), содержащие вторичную аминную группировку (═NH). Они близки по физико-химическим свойствам к истинным аминокислотам и выполняют сходные биологические функции.
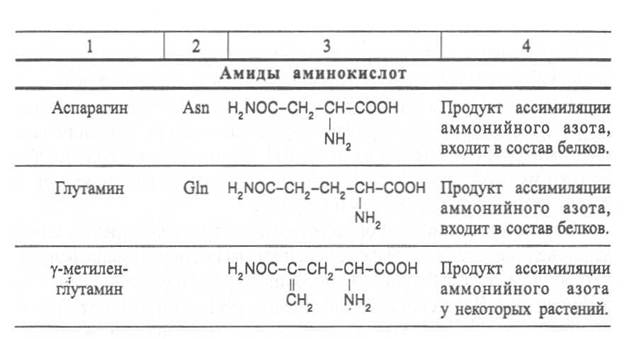
Важные функции в растительном организме выполняют производные аминокислот – амиды и бетаины, из которых наиболее хорошо изучены аспарагин, глутамин и гликоколбетаин. Аспарагин и глутамин участвуют в построении белковых молекул, являются продуктами обмена многих азотистых веществ. Гликоколбетаин ─ продукт азотного обмена у некоторых растений, служит активным донором метильных групп.
Все аминокислоты, за исключением глицина, содержат асимметрические атомы углерода и проявляют оптическую активность.
D- и L -формы аминокислот различают по положению водорода и аминогруппы у α-углеродного атома. За эталон сравнения принимаются конфигурации молекул L- и D -серина. Изомеры аминокислот, имеющие расположение в пространстве водорода и аминогруппы у α-углеродного атома такое же, как у L -серина, относят L- ряду, а сходное с конфигурацией молекулы D -серина – к D -ряду.
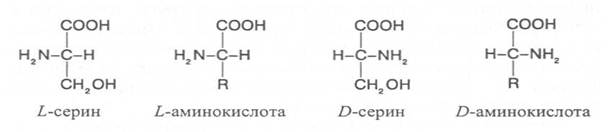
Направление и угол вращения плоскости поляризации света у разных аминокислот и их оптических изомеров зависит от строения радикала R, реакции среды (рН), природы растворителя и растворённых в нём веществ.
Подавляющее большинство природных аминокислот синтезируется в организмах в виде L -форм, а D -формы аминокислот встречаются редко, чаще всего в клетках микроорганизмов. При химическом синтезе образуется смесь L - и D -изомеров аминокислот.
Ферментные системы растений, человека и животных специфически приспособлены катализировать биохимические реакции, происходящие с участием L -изомеров аминокислот, и не способны к превращениям D -изомеров, которые даже могут ингибировать биохимические процессы в организме. В опытах установлено, что только метионин может усваиваться организмами человека и животных как в L- форме, так и D- форме.
Первые аминокислоты были открыты в начале XIX века, а к концу этого века уже были выделены и изучены почти все аминокислоты, входящие в состав белков. В настоящее время известно более 200 аминокислот. Важнейшая биологическая роль аминокислот - построение белковых молекул. Аминокислоты, участвующие в синтезе белков, принято называть протеиногенными, их насчитывается 18. Кроме того, в синтезе белков принимают участие два амида - аспарагин и глутамин.
После синтеза белковой молекулы в ней могут происходить модификации радикалов некоторых аминокислот, поэтому при анализе состава белков, кроме протеиногенных, обнаруживают некоторые другие аминокислоты (оксипролин, оксилизин и др.).
Аминокислоты, не участвующие в синтезе белков, являются важными метаболитами, с участием которых происходит синтез протеиногенных аминокислот, а также всех других азотистых веществ растительного организма: нуклеотидов, амидов, азотистых оснований, алкалоидов, некоторых липидов, многих витаминов, хлорофилла, фитогормонов (ауксинов, цитокининов), некоторых фитонцидов. Строение и биологическая роль важнейших аминокислот представлены в таблице 1.
|
|
|
Растения и природные формы микроорганизмов способны синтезировать все необходимые им аминокислоты из других органических веществ, тогда как организмы человека и животных не способны к синтезу некоторых аминокислот, входящих в состав белков. Эти аминокислоты называют незаменимыми и они должны поступать в организм с пищей.
Для взрослого человека незаменимыми являются 8 аминокислот: лизин, триптофан, метионин, треонин, лейцин, валин, изолейцин, фенилаланин. Для детей и некоторых групп животных незаменимыми также являются аргинин, гистидин и цистеин. При недостатке незаменимых аминокислот ослабляется синтез белков, что может быть причиной тяжелых заболеваний. А их недостаток в растительных кормах снижает выход животноводческой продукции в расчете на единицу массы затраченного корма, в результате чего повышается ее себестоимость.
В целях составления правильного пищевого рациона для каждого вида организмов с учетом возрастного и физического состояния определены ежедневные нормы потребления незаменимых аминокислот. В среднем для человека они составляют, г: валин–5,0, лейцин–7,0, изолейцин –4,0, лизин–5,5, триптофан–1,0, треонин–4,0, метионин–3,5, фенилаланин –5,0.
Чаще всего в кормах сельскохозяйственных животных в недостаточном количестве содержатся такие незаменимые аминокислоты, как лизин, триптофан и метионин. Для балансирования кормов по содержанию
этих аминокислот разработаны промышленные способы их получения. В связи с тем, что лизин и триптофан усваиваются животными только в виде L - изомеров, то для производства кормовых препаратов указанных аминокислот применяют микробиологический синтез, при котором реализуется природный механизм образования L -изомеров аминокислот. Поскольку метионин может усваиваться животными в виде D- и L- форм, то для его промышленного получения используется менее затратный химический синтез, дающий рацемическую смесь оптических изомеров этой аминокислоты.
|
|
|
Содержание свободных аминокислот в растениях зависит от вида органа или ткани, возраста растений, внешних условий и особенно подвержено большим изменениям в зависимости от интенсивности протекания тех биохимических процессов, которые сопряжены с их потреблением (синтез белков, нуклеиновых кислот и других азотистых веществ). Концентрация аминокислот повышается при ослаблении ростовых процессов, недостатке питательных элементов, избыточном азотном питании, усилении процессов распада белков при старении растений или прорастании семян.
Концентрации отдельных аминокислот могут возрастать в результате метаболитных нарушений в организме и под воздействием стрессов. Так, например, при вододефицитном стрессе в клетках растений происходит накопление аминокислоты пролина, а при избыточном аммонийном питании – накопление аспарагина, глутамина и аргинина.
 |

 2014-02-17
2014-02-17 3355
3355
