Метод валентных связей
Представления о механизме образования химической связи на примере молекулы водорода распространяются и на другие молекулы. Теория химической связи, созданная на этой основе, получила название метода валентных связей (МВС).
Основные положения:
1) ковалентная связь образуется в результате перекрывания двух электронных облаков с противоположно направленными спинами, причем образованное общее электронное облако принадлежит двум атомам;
2) ковалентная связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака. Степень перекрывания электронных облаков зависит от их размеров и плотности;
3) образование молекулы сопровождается сжатием электронных облаков и уменьшением размеров молекулы по сравнению с размерами атомов;
4) в образовании связи принимают участие s- и p-электроны внешнего энергетического уровня и d-электроны предвнешнего энергетического уровня.
В молекуле хлора каждый его атом имеет завершенный внешний уровень из восьми электронов s2 p6, причем два из них (электронная пара) в одинаковой степени принадлежит обоим атомам. Перекрывание электронных облаков при образовании молекулы показано на рисунке
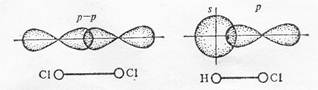
а б
Схема образования химической связи в молекулах хлора Cl2 (а) и хлороводорода HCl (б)
Химическая связь, для которой линия, соединяющая атомные ядра, является осью симметрии связывающего электронного облака, называется сигма (σ)-связью. Она возникает при «лобовом» перекрывании атомных орбиталей. Связи при перекрывании s-s-орбиталей в молекуле Н2; р-р-орбиталей в молекуле Cl2 и s-p-орбиталей в молекуле НСl являются сигма связями. Возможно «боковое» перекрывание атомных орбиталей. При перекрывании р-электронных облаков, ориентированных перпендикулярно оси связи, т.е. по оси у- и z-осям, образуются две области перекрывания, расположенные по обе стороны от этой оси.
Такая ковалентная связь называется пи (p)-связью. Перекрывание электронных облаков при образовании π-связи меньше. Кроме того, области перекрывания лежат дальше от ядер, чем при образовании σ-связи. Вследствие этих причин π-связь обладает меньшей прочностью по сравнению с σ-связью. Поэтому энергия двойной связи меньше удвоенной энергии одинарной связи, которая всегда является σ-связью. Кроме того, σ-связь имеет осевую, цилиндрическую симметрию и представляет собой тело вращения вокруг линии, соединяющей атомные ядра. π-Связь, наоборот, не обладает цилиндрической симметрией.
Одинарная связь всегда является чистой или гибридной σ-связью. Двойная же связь состоит из одной σ- и одной π-связей, расположенных перпендикулярно друг относительно друга. σ-Связь прочнее π-связи. В соединениях с кратными связями обязательно присутствует одна σ-связь и одна или две π-связи.
 2014-02-18
2014-02-18 18069
18069







