При повышении температуры согласно принципу Ле-Шателье равновесие смещается в сторону эндотермического процесса испарения. В результате чего количество молекул жидкости над ее поверхностью начнет увеличиваться. Это приведет к возрастанию давления насыщенного пара, когда система снова придет в равновесие.
Рис. 26. Принцип применения гипертонических повязок для очистки пораженных тканей от гноя и продуктов распада
Гипертонические растворы вводят внутривенно при глаукоме, чтобы снизить внутриглазное давление из-за повышенного содержания жидкости в передней камере глаза.
Явлением осмоса объясняют слабительное действие глауберовой (Na2SO4 · 10H2O) и горькой (MgSO4 · 7H2O) солей.
Эти соли плохо всасываются в кровь и поэтому их высокая концентрация в кишечнике вызывает интенсивный переход воды внутрь его из окружающих тканей, способствуя послабляющему действию.
Многие бактериальные клетки имеют высокое осмотическое давление. При действии антибиотиков (например, пенициллина) ингибируется процесс биосинтеза стенок растущих стрептококков. Они становятся непрочными и под действием внутреннего осмотического давления легко разрушаются.
Таким образом, понимание осмотических процессов и контроль за ними, а также умение оказывать на их протекание то или иное воздействие имеет крайне важное значение в биологии и медицине.
Давление насыщенного пара растворителя
над раствором. Закон Рауля
Если в замкнутый сосуд, из которого предварительно удалили воздух, поместить чистый растворитель, например, воду (рис. 27), то в результате естественного процесса испарения над жидкостью образуется пар. Он будет состоять из молекул жидкости, оторвавшихся от ее верхнего слоя в результате своего хаотического теплового движения и перешедших в газовую фазу. На совершение данного процесса необходимо затратить определенное количество энергии, чтобы преодолеть силы притяжения между молекулами жидкой фазы. Эндотермический процесс испарения обратим. По мере накопления молекул в газовой фазе над поверхностью жидкости одновременно начнет протекать и обратный процесс – конденсация пара, т.е. переход молекул растворителя обратно в жидкость. Причем конденсация является экзотермическим процессом и сопровождается выделением теплоты.
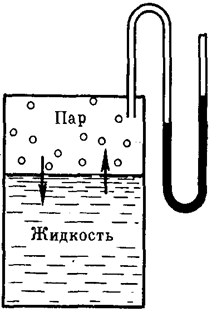
Рис. 27. Равновесие жидкость – пар (схема)
Со временем скорости обоих процессов уравняются и в системе установится динамическое равновесие, при котором число молекул растворителя, испарившихся с поверхности жидкости за единицу времени, будет равно числу молекул, перешедших в жидкость из газообразной среды. Но при этом какое-то постоянное и не меняющееся во времени число молекул растворителя будет находиться над его поверхностью, образуя насыщенный пар. Давление этого пара на жидкость называют давлением насыщенного пара чистого растворителя (р0). Его можно измерить с помощью манометра (рис. 27).
При неизменной температуре и внешнем давлении р0 остается постоянным, зависит только от природы жидкости и поэтому является одной из ее физических характеристик.
Так, при 293 K (20оС) давление насыщенного пара Н2О равно 2,319 кПа; этилового спирта – 5,85 кПа; диэтилового эфира – 58,93 кПа.
Если растворить небольшое количество какого-нибудь нелетучего вещества[*] (молекулы которого не могут переходить в газовую фазу), концентрация свободных молекул растворителя в верхнем слое жидкости уменьшится, т.к. часть мест там займут частицы растворенного вещества. Они к тому же будут удерживать вокруг себя (связывать) ближайшие молекулы растворителя, формируя из них сольватные оболочки.
В этом случае равновесие между жидкостью и ее насыщенным паром устанавливается при более низком давлении (р) по сравнению с давлением насыщенного пара над чистым растворителем (р0).
Опытным путем было установлено, что для растворов понижение давления насыщенного пара растворителя (р0 – р = Dр) не зависит от природы растворенного вещества, а определяется только его концентрацией.
Французский физик Франсуа Рауль установил математическую зависимость между р и мольной долей растворителя, которая называется законом Рауля:
р = р0c2,
где c2 – мольная доля растворителя в растворе.

Франсуа Мари Рауль (1830 – 1901) – французский химик и физик, член-корреспондент Парижской АН (1890). С 1867 работал в Гренобльском университете (профессор с 1870). Член-корреспондент Петербургской АН (1899). Исследуя в 1882–1888 понижение температуры кристаллизации, а также понижение давления пара (или повышение температуры кипения) растворителя при введении в него растворённого вещества, открыл закон, применяемый для определения молекулярных масс веществ в растворённом состоянии (закон Рауля).
Часто закон Рауля математически записывают по-другому:
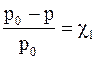 или
или 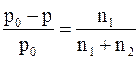 ,
,
где 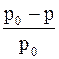 – относительное понижение давления насыщенного пара растворителя над раствором; c1 – мольная доля растворенного вещества; n1 – химическое количество (моль) растворенного вещества; n2 – химическое количество растворителя.
– относительное понижение давления насыщенного пара растворителя над раствором; c1 – мольная доля растворенного вещества; n1 – химическое количество (моль) растворенного вещества; n2 – химическое количество растворителя.
В этом случае его формулировка звучит несколько иначе:
 2014-02-09
2014-02-09 797
797








