Рис. 22. Схематическое изображение опыта для обнаружения осмоса
Преимущественно односторонняя самопроизвольная диффузия молекул растворителя через полупроницаемую мембрану из растворителя в раствор или из раствора с меньшей концентрацией растворенного вещества в раствор с большей его концентрацией называется осмосом.
Рис. 21. Схема процесса диффузии для двух растворов разной концентрации
Таким образом, согласно закону Фика, скорость диффузии вещества пропорциональна площади поверхности, через которую переносится вещество и градиенту его концентрации.
Явление диффузии играет чрезвычайно важную роль в жизнедеятельности организмов, в процессах перемещения питательных веществ и продуктов обмена в тканевых жидкостях.
Диффузия может проходить также, если на границе раствора и чистого растворителя (или двух растворов с различной концентрацией) поместить полупроницаемую перегородку – мембрану, которая способна пропускать только молекулы растворителя и не пропускает частицы растворенного вещества.
Это связано с тем, что мембрана содержит отверстия или поры определенного диаметра. Через них могут легко проходить только свободные молекулы растворителя. Сольватированные молекулы или ионы растворенного вещества через эти отверстия не проходят.
Свойством полупроницаемости обладают оболочки клеток человека, животных и растений (биологические мембраны), а также некоторые пленки искусственного происхождения: целлофан, пергамент.
Явление осмоса можно наблюдать, если U-образную стеклянную трубку разделить на 2 части (2 колена) полупроницаемой перегородкой, способной пропускать через себя только молекулы растворителя. В одно колено (например, правое) следует поместить раствор какого-нибудь вещества (глюкозы), а в другое – растворитель (Н2О). При этом уровень жидкости по обе стороны мембраны должен быть одинаковым (рис. 22). Молекулы воды могут переходить через мембрану в обоих направлениях, однако будет наблюдаться их преимущественная диффузия из растворителя (где их концентрация больше) в раствор, вследствие чего уровень жидкости в левом колене станет постепенно понижаться, а в правом – наоборот, увеличиваться.
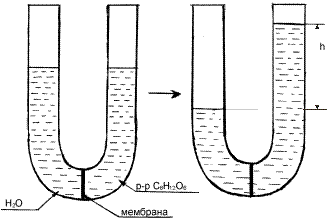
Со временем скорость перехода молекул растворителя через мембрану в обоих направлениях уравняется и подъем жидкости в правом колене прекратится. Причем, чем больше была концентрация вещества в исходном растворе, тем на большую величину (h) поднимется в нем уровень жидкости до наступления динамического (или в данном случае осмотического) равновесия.
Этот избыточный столб жидкости будет оказывать гидростатическое давление на мембрану со стороны раствора и тем самым препятствовать переходу через нее молекул растворителя в раствор, способствуя установлению осмотического равновесия.
Гидростатическое давление можно измерить экспериментально с помощью осмометра Пфеффера (рис. 23) или рассчитать по формуле:
p = h · S · r · g
где h – высота избыточного столба жидкости, который устанавливается над раствором в результате осуществления осмоса; S – площадь поперечного сечения сосуда с раствором; r – плотность раствора; g – ускорение силы тяжести.
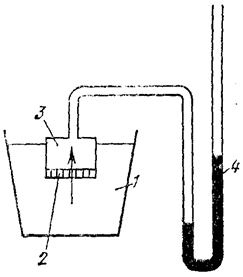
Рис. 23. Схема осмометра Пфеффера:
1 – сосуд с растворителем; 2 – мембрана; 3 – ячейка с раствором;
4 – манометр
Гидростатическое давление, оказываемое избыточным столбом жидкости, образовавшимся в результате осуществления осмоса, называют иначе осмотическим давлением раствора. Его можно измерить экспериментально и другим способом (рис. 24). В этом случае осмотическое давление будет равно тому минимальному внешнему давлению, которое нужно оказать на раствор, чтобы не дать осуществиться осмосу. Для того, чтобы сделать это практически, в сосуд с раствором нужно поместить запирающий раствор поршень, который плотно прилегает к стенкам сосуда и может свободно передвигаться вдоль них.
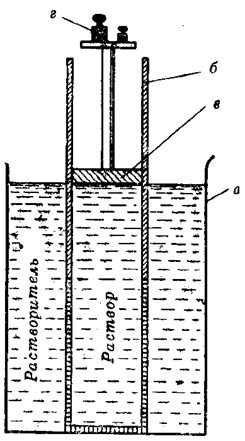
Рис. 24. Схема опыта, поясняющего измерение осмотического давления: а – сосуд с растворителем; б – сосуд с раствором, стенки которого образованы полупроницаемой мембраной; в – поршень;
г – груз
Осмотическое давление растворов определяют по отношению к чистому растворителю и измеряют в Па или Н/м2 (ньютонах на квадратный метр).
Наблюдаемое на практике значение осмотического давления, возникающего при соприкосновении через мембрану растворов с различной концентрацией, равно разности их осмотических давлений, определенных относительно чистого растворителя.
Как показали исследования, осмотическое давление зависит в первую очередь от содержания вещества в растворе и может достигать значительных величин. Так 3,85% раствор сахарозы при комнатной температуре имеет осмотическое давление
≈ 0,3 МПа (3 атм), а 34,64% раствор – ≈ 10 МПа (100 атм). Осмотическое давление морской воды средней солености ≈ 0,27 МПа, а у рассолов солевых озер – более 20 МПа.
Измерение осмотического давления для разбавленных растворов различных веществ показало, что его величина не зависит от природы полупроницаемой мембраны и растворенного вещества, но пропорционально возрастает при увеличении молярной концентрации и абсолютной температуры раствора. Причем, коэффициент пропорциональности оказался универсальной константой, численно равной газовой постоянной R. Эти экспериментальные результаты позволили голландскому ученому Вант-Гоффу в 1887 г. вывести формулу для теоретического расчета осмотического давления раствора, которая называется иначе законом Вант-Гоффа:
росм. = C · R · T
где С – молярная концентрация вещества в растворе; Т - абсолютная температура раствора (в градусах Кельвина); R – универсальная газовая постоянная, равная 8,314 кПа · л/моль · K.

Якоб Гендрик Вант-Гофф (1852 – 1911)
С 1878 г. профессор химии в Амстердамском университете, с 1895 г. работает в Берлинском университете, является членом Прусской академии наук.
Научная деятельность Вант-Гоффа многообразна. Выдающиеся исследования выполнены им в области учения о равновесиях и химической термодинамике и кинетике. В 1885 г. ученым была представлена теория разбавленных растворов, в которой Вант-Гофф с термодинамических позиций обосновал применение газовых законов Р.Бойля и Ж. Гей-Люссака к разведенным растворам и показал, что уравнение Клапейрона применимо к расчету осмотического давления. В этой же работе Вант-Гофф предложил несколько способов для определения изотонического коэффициента i.
Учитывая, что С = n / V, закон Вант-Гоффа можно записать иначе
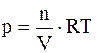 или pV = nRT
или pV = nRT
Данная форма записи закона Вант-Гоффа показывает его сходство с уравнением Менделеева-Клапейрона для идеальных газов, на основании чего формально можно считать, что осмотическое давление раствора численно равно тому давлению, которое производило бы растворенное вещество, если бы оно находилось в газообразном состоянии и при данной температуре Т занимало тот же объем, что и раствор.
Закон Вант-Гоффа соблюдается для растворов неэлектролитов, молярная концентрация которых не превышает 1 · 10–2 моль/дм3. При более высоких концентрациях наблюдаются отклонения от закона Вант-Гоффа.
Осмос имеет большое значение в жизнедеятельности человека, животных и растительных организмов. Как известно, все биологические ткани состоят из клеток, внутри которых находится жидкость (цитоплазма), представляющая собой раствор различных веществ в Н2О. Оболочка клетки полупроницаема и через нее достаточно свободно проходит вода.
Ионы электролитов и молекулы других веществ оболочка пропускает строго избирательно.
Снаружи клетки омываются межклеточной жидкостью, тоже представляющей собой водный раствор. Причем концентрация растворенных веществ внутри клеток больше, чем в межклеточной жидкости. Вследствие осмоса наблюдается переход растворителя из внешней среды в клетку, что вызывает ее частичное набухание или тургор. При этом клетка приобретает соответствующую упругость и эластичность. Тургор способствует сохранению определенной формы органов у животных организмов, стеблей и листьев у растений. В срезанных растениях в результате испарения воды объем меж- и внутриклеточной жидкости уменьшается, снижается осмотическое давление, упругость клеток понижается и растение вянет. Увлажнение растений, помещение их в воду вызывает осмос и снова сообщает тканям упругость.
Кровь, лимфа, тканевые жидкости человека представляют собой водные растворы молекул и ионов многих веществ и обладают вследствие этого определенным осмотическим давлением. Причем на протяжении всей жизни организма биологические жидкости сохраняют свое давление на постоянном уровне, независимо от состояния внешней среды. Это явление называется иначе изоосмией человеческого организма и является составной частью более общего процесса – гомеостазаили постоянства ряда физико-химических показателей внутренней среды человека в изменяющихся внешних условиях.
Изоосмия особенно присуща таким биологическим жидкостям, как кровь и лимфа. Так, осмотическое давление крови у человека практически постоянно, и при 37оС изменяется в пределах 740-780 кПа (т.е., почти в 8 раз больше атмосферного).
Осмотическое давление крови у разных живых организмов неодинаково. Так, у лягушек оно ниже, чем у человека, а у некоторых морских животных, наоборот, больше.
При изменении осмотического давления крови организм стремится восстановить его, удалив из крови избыточное количество растворенных частиц (если давление повышается) или, наоборот, увеличивая число кинетически активных частиц (если давление понижается). Основную роль в регуляции осмотического давления крови играют почки. В меньшей степени в сохранении изоосмии участвуют ткани печени и подкожной клетчатки. Они способны накапливать избыточные количества солей. При поражении почек вклад подкожной клетчатки в поддержание осмотического давления резко увеличивается. Содержание солей в ее клетках возрастает, что приводит вследствие осмоса к значительному увеличению объема клеток и появлению отечности.
Изоосмия регулируется, прежде всего, центральной нервной системой и деятельностью желез внутренней секреции.
Отклонение осмотического давления крови от нормы вызывает болезненное состояние. Так, при его понижении наблюдаются рвота, судороги, затемнение сознания. Повышение осмотического давления сопровождается отечностью, нарушением сердечной деятельности.
В некоторых случаях изменения осмотического давления в ограниченных участках тканей могут быть довольно большими. Так, при локальных воспалительных процессах белковые молекулы в клетках распадаются на массу более мелких фрагментов, увеличивая, тем самым, число растворенных частиц в них. Вода из окружающих тканей и сосудов устремляется в эти клетки и значительно увеличивает их объем. При этом в районе воспалительного очага возникает опухоль, при разрезе или проколе которой гнойная жидкость вытекает из нее под большим давлением.
Растворы, осмотическое давление которых равно осмотическому давлению раствора, принятого за стандарт, называются изотоническими. В медицине осмотическое давление растворов сравнивают с осмотическим давлением крови. Изотоническими по отношению к крови являются 0,9% (0,15 М) раствор NaCl и 4,5-5% раствор глюкозы. В этих растворах концентрация частиц растворенного вещества такая же, как и в плазме крови. Отличие состоит лишь в том, что в состав крови входит не только NaCl или глюкоза, но и целый ряд других веществ. Их суммарная концентрация носит название осмолярности (изотонической концентрации) и представляет собой химическое количество всех кинетически активных (т.е. способных к самостоятельному движению) частиц (независимо от их формы, размеров и природы), содержащихся в 1 литре плазмы крови.
Осмолярная концентрация крови у человека составляет 0,287-0,303 моль/л.
Изотонические растворы NaCl и глюкозы называют часто физиологическими растворами. Хотя в настоящее время этот термин для них признан неудачным, т.к., строго говоря, истинным физиологическим раствором является раствор, по своему количественному и качественному составу максимально приближенный к плазме крови.
Растворы, обладающие более высоким осмотическим давлением, чем плазма крови, называются гипертоническими, а растворы, имеющие более низкое давление – гипотоническими .
При различных лечебных процедурах в кровь человека в больших количествах следует вводить только изотонические растворы, чтобы не вызвать осмотический конфликт из-за резкого несоответствия между осмотическим давлением биологической жидкости и вводимого раствора.
При контакте клетки с гипертоническим раствором происходит отток воды из клетки через мембрану в окружающую среду. Клетка при этом теряет свою упругость вследствие обезвоживания и уменьшается в объеме (сморщивается). Нормальное течение физических и химических процессов в ней нарушается (рис. 25).
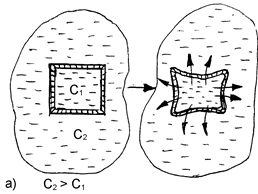
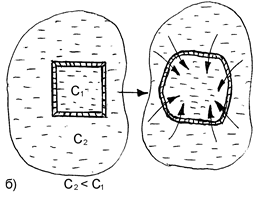
Рис. 25. Схематическое изображение процессов плазмолиза (а) и лизиса (б), протекающих в результате помещения клетки, соответственно, в гипертонический или гипотонический растворы
Данное явление называется плазмолизом или экзосмосом.
Плазмолиз в большинстве случаев является обратимым процессом. Плазмолизированные клетки, помещенные в изотонический раствор, вновь набухают, восстанавливая свою жизнедеятельность. Но при слишком сильном и продолжительном обезвоживании клетка может потерять свою жизнеспособность.
При контакте с гипотоническим раствором вода из внешней среды переходит внутрь клетки. В результате этого клетка увеличивается, и может произойти разрыв ее оболочки. Данное явление называется лизисом или эндосмосом (рис. 25).
Если в качестве клеточной культуры использовать эритроциты, то вследствие разрыва их оболочек внешняя среда окрасится гемоглобином в красный цвет. В этом случае данное явление называют иначе гемолизом (или эритроцитолизом).
Гемолиз является частным случаем более общего явления – цитолиза (разрушения животных и растительных клеток под влиянием различных причин).
В крови разрушение оболочки у всех эритроцитов наступает если ее осмотическое давление снижается до 260-300 кПа. Цвет крови при этом частично изменяется и принимает характерный, «лаковый» оттенок.
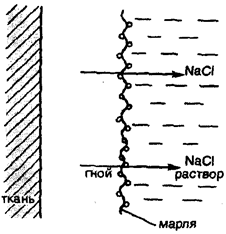
В клинической практике в некоторых случаях могут применяться не только изотонические, но и гипертонические растворы. Например, в хирургии используют марлевые полоски, смоченные в гипертоническом растворе NaCl, для наложения на гнойные раны. При этом вследствие осмоса ток жидкости направляется по марле наружу из раны, что способствует постоянному очищению раны от гноя, микроорганизмов, продуктов распада и т.д. (рис. 26).
 2014-02-09
2014-02-09 4006
4006







