В электрохимическом ряду напряжений восстановительная активность металлов в водных растворах уменьшается с ростом их нормального электродного потенциала. Металлы, стоящие в начале ряда, легко отдают свои валентные электроды и превращаются в положительно заряженные ионы. Металлы, стоящие в конце ряда, делают это с трудом.
Значение нормального электродного потенциала количественно характеризует способность металла отдавать электроны, т.е. его восстановительные свойства.
Разность потенциалов между металлом, погруженным в раствор своей соли, с активностью ионов Men+ в нём, равной 1 моль/дм3, и стандартным водородным электродом, измеренная при 298 K, называется стандартным или нормальным электродным потенциалом металла (Е0).
Если все металлы расположить последовательно по возрастающей величине их нормальных электродных потенциалов, получится электрохимический ряд напряжений металлов или ряд их активности (табл. 21).
Таблица 21. Электрохимический ряд напряжений металлов
| Электрод | Электродная реакция | Е0, В | Электрод | Электродная реакция | Е0, В |
| Li / Li+ | Li ↔ Li+ + ē | -3,045 | Cd / Cd2+ | Cd ↔ Cd2+ + 2ē | -0,403 |
| K / K+ | K ↔ K+ + ē | -2,924 | Co / Co2+ | Co ↔ Co2+ + 2ē | -0,277 |
| Ba / Ba2+ | Ba ↔ Ba2+ + 2ē | -2,900 | Ni / Ni2+ | Ni ↔ Ni2+ + 2ē | -0,250 |
| Ca / Ca2+ | Ca ↔ Ca2+ + 2ē | -2,866 | Sn / Sn2+ | Sn ↔ Sn2+ + 2ē | -0,136 |
| Na / Na+ | Na ↔ Na+ + ē | -2,714 | Pb / Pb2+ | Pb ↔ Pb2+ + 2ē | -0,126 |
| Mg / Mg2+ | Mg ↔ Mg2+ + 2ē | -2,363 | Fe / Fe3+ | Fe ↔ Fe3+ + 3ē | -0,037 |
| Al / Al3+ | Al ↔ Al3+ + 3ē | -1,663 | H2 / 2H+ | H2 ↔ 2H+ + 2ē | |
| Mn / Mn2+ | Mn ↔ Mn2+ + 2ē | -1,179 | Cu / Cu2+ | Cu ↔ Cu2+ + 2ē | 0,337 |
| Cr / Cr2+ | Cr ↔ Cr2+ + 2ē | -0,913 | Ag / Ag+ | Ag ↔ Ag+ + ē | 0,799 |
| Zn / Zn2+ | Zn ↔ Zn2+ + 2ē | -0,763 | Hg / Hg2+ | Hg ↔ Hg2+ + 2ē | 0,850 |
| Cr / Cr3+ | Cr ↔ Cr3+ + 3ē | -0,744 | Pt / Pt2+ | Pt ↔ Pt2+ + 2ē | 1,188 |
| Fe / Fe2+ | Fe ↔ Fe2+ + 2ē | -0,440 | Au / Au3+ | Au ↔ Au3+ + 3ē | 1,498 |
В этой таблице каждый электрод обозначен символом элемента, из которого он состоит, и соответствующего его катиона. Вертикальная черта изображает поверхность раздела двух фаз, где происходит скачок потенциала.
Зная стандартный электродный потенциал металла, можно рассчитать по уравнению Нернста его электродный потенциал при любой концентрации или активности ионов Men+ в растворе.
Следует отметить, что подготовка водородного электрода к работе сопряжена со значительными трудностями. Давление, под которым подаётся газообразный Н2 к платиновой пластинке, должно быть постоянным и равным 101,325 кПа. Кроме того, не должна изменяться и скорость подвода газа. Сам водород должен быть совершенно чистым, так как уже весьма малые количества примесей (особенно H2S и AsH3), «отравляют поверхность платины и тем самым препятствуют установлению равновесия
Н2 «2Н+ + 2ē
Получение Н2 высокой степени чистоты связано со значительным усложнением аппаратуры и самого процесса работы. Поэтому на практике в качестве электродов сравнения часто используют каломельный или хлорсеребряный электроды. Они более компактные, обладают устойчивым потенциалом, мало зависящим от внешних условий.
Их стандартные электродные потенциалы определяют относительно водородного электрода.
При использовании насыщенного раствора KCl:
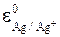 = 0,222 B (222 мV),
= 0,222 B (222 мV), 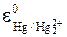 = 0,242 B (242 мV)
= 0,242 B (242 мV)
Особенно удобным является хлорсеребряный электрод, т.к. его составные части, в отличие от каломельного электрода, не являются токсичными и не требуют специальных мер предосторожности в работе.
Существуют растворы, содержащие в своем составе два вещества, в которых атомы одного и того же элемента находятся в разной степени окисленности. Такие растворы называются иначе окислительно-восстановительными системами или редокс-системами (от латинского«reduction»– восстановление и «oxydation» – окисление).
 2014-02-09
2014-02-09 1103
1103








