Активные металлы (магний, цинк, железо, кобальт и т.д.) и в воде, и в растворе собственной соли, как правило, заряжаются отрицательно. Пластинки малоактивных металлов (таких как медь, ртуть, серебро и т.д.) в растворе собственной соли, наоборот, заряжаются положительно, т.к. их катионы с поверхности кристаллической решетки могут переходить в раствор в незначительных количествах и поэтому до наступления равновесия преобладает обратный процесс – осаждение катионов из раствора на металл. В результате пластинка приобретает положительный заряд, а раствор, в котором остались анионы соли – отрицательный заряд.
Рис. 86. Схема, объясняющая возникновение разности электрического потенциала на границе металл – вода
Схематически протекающие при этом процессы можно изобразить следующим образом:
Ме – ē «Меn+
Двойной электрический слой, возникающий на границе раздела между металлом и жидкостью, имеет не плоское, а диффузионное строение. Электростатическому притяжению катионов со стороны пластинки противодействуют силы взаимного отталкивания между ионами Меn+ и их тепловое движение. По мере удаления от поверхности металла концентрация его катионов в водном слое убывает.
Если металлическую пластинку опустить не в воду, а в раствор соли этого металла, то величина заряда, возникающего на пластинке при установлении равновесия, будет определяться ещё и концентрацией ионов металла в исходном растворе.
Это связано с тем, что в ионообменных процессах в данном случае смогут принимать участие и катионы добавленного электролита.
Система, состоящая из металлической пластинки, опущенной в раствор собственной соли, называется металлическим электродом. Разность потенциалов, которая устанавливается между пластинкой и прилегающим к ней водным слоем, называется электродным потенциалом.
Его величина будет определяться не только прочностью связей в кристаллической решетке металла и температурой системы, но и активностью катионов металла соли в растворе. Эта зависимость выражается уравнением Нернста:
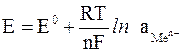
где Е – электродный потенциал, В; Е0 – стандартный электродный потенциал, т.е. потенциал, который возникает на электроде при активности ионов металла соли в растворе, равной 1 моль/дм3 и температуре 298 K (25оС); R – универсальная газовая постоянная, 8,314 Дж/(моль ∙ K); Т – температура, K; n - величина заряда иона металла; F – постоянная Фарадея, равная 96500 Кл/моль; 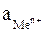 – активность ионов металла в растворе.
– активность ионов металла в растворе.
Для достаточно разбавленных растворов солей активность ионов металла можно заменить их молярной концентрацией.
В этом случае для температуры 298 K при переходе от натурального логарифма к десятичному и подстановке значений констант R и F уравнение Нернста принимает более простой вид:
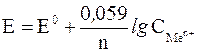
где 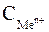 – молярная концентрация ионов металла в растворе.
– молярная концентрация ионов металла в растворе.
Металлические электроды подразделяются на электроды первого и второго рода.
Электроды первого рода – это электроды, состоящие из металлической пластинки, опущенной в раствор собственной соли. Величина электродного потенциала для них зависит только от активности катионов соли.
Электроды второго рода состоят из малоактивного металла, покрытого слоем труднорастворимой собственной соли и погруженного в раствор какой-либо легкорастворимой соли, содержащей те же анионы, что и у нерастворимой соли. Потенциал такого электрода зависит как от активности ионов металла в растворе, так и от активности общего для двух солей аниона.
В последнем случае его рассчитывают следующим образом:
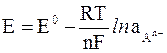
где 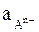 – активность аниона легкорастворимой соли; n – величина заряда аниона.
– активность аниона легкорастворимой соли; n – величина заряда аниона.
Хлорсеребряный электрод состоит из серебряной проволоки, покрытой малорастворимой в воде солью AgCl и погруженной в раствор хлорида калия (рис. 87).

Рис. 87. Хлорсеребряный электрод:
1 – серебряная проволока; 2 – слой AgС1;
3 – раствор КС1; 4 – микрощель для контакта с внешним раствором
Ионы Ag+ образуются в растворе при частичном растворении соли AgCl
AgCl «Ag+ + Cl–
Концентрация их будет определяться не только растворимостью хлорида серебра, но и содержанием хлорида калия, который при диссоциации тоже образует ионы Cl– и смещает равновесие вышеприведенной реакции в сторону осаждения из раствора AgCl. Это, в свою очередь, приведет к уменьшению концентрации ионов Ag+ в растворе.
Каломельный электрод состоит из металлической ртути, покрытой пастой плохо растворимого хлорида ртути(I) Hg2Cl2 (иначе каломели), контактирующей с водным раствором KCl (рис. 88).
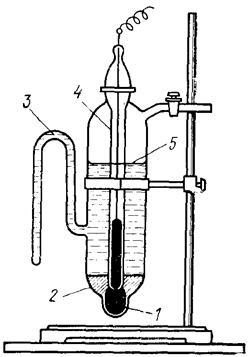
Рис. 88. Каломельный электрод: 1 – ртуть; 2 – паста из каломели;
3 – отросток для соединения каломельного электрода с другими электродами; 4 – платиновая проволока; 5 – раствор хлорида калия
Каломель, растворяясь в Н2О, диссоциирует с образованием ионов Нg22+ и Cl–:
Нg2Cl2 «Нg22+ + 2Cl–
В присутствии хлорида калия, содержащего одноименный с каломелью ион Cl–, растворимость Нg2Cl2 и концентрация ионов Нg22+ будет уменьшаться в зависимости от количества в растворе добавленной соли KCl и входящих в её состав ионов Cl–.
Потенциал хлорсеребряного и каломельного электродов рассчитывают по уравнению
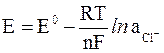
где 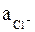 – активность ионов Cl–, образующихся при растворении KCl.
– активность ионов Cl–, образующихся при растворении KCl.
Это связано с тем, что легче измерить в растворе активность ионов Cl–, чем активность катионов Ag+ или Нg22+, образующихся при растворении плохо растворимой соли.
 2014-02-09
2014-02-09 4856
4856








