В состоянии термодинамического равновесия система может быть описана аддитивными функциями состояния, которые называются термодинамическими потенциалами. Это описание будет полным, если они заданы как функции естественных независимых переменных.
Если внутреннюю энергию системы рассматривать как функцию
U (S, V) энтропии и объема, то ее элементарное приращение в произвольном равновесном процессе можно представить полным дифференциалом
dU = 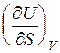 dS +
dS + 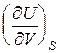 dV. (9.1)
dV. (9.1)
Сравним это выражение с основным термодинамическим тождеством:
dU = TdS – PdV, (9.2)
Если известна зависимость U (S, V), то температура и давление могут быть найдены как частные производные этой функции:
T = 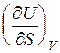 , P = –
, P = –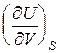 . (9.3)
. (9.3)
Итак, внутренняя энергия U (S, V), рассматриваемая как функция энтропии и объема, представляет собой термодинамический потенциал. Изменение внутренней энергии в изохорном процессе равно полученной системой теплоте.
Можно ввести также и другие функции, которые будут термодинамическими потенциалами. Энтальпия определяется формулой:
H = U + PV. (9.4)
Ее дифференциал равен
dH = dU + PdV + VdP = TdS + VdP. (9.5)
Если известна зависимость энтальпии от энтропии и давления, то температура и объем могут быть найдены как
T = 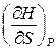 , V =
, V = 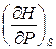 . (9.6)
. (9.6)
Изменение энтальпии в изобарном процессе равно полученной теплоте.
Если определить свободную энергию системы как
F = U – TS, (9.7)
то ее дифференциал (приращение в равновесном процессе) будет равен
dF = dU – TdS – SdT = – SdT – PdV. (9.8)
Отсюда видно, что естественными переменными для свободной энергии
F (T, V) будут температура и объем, а энтропия и давление могут быть найдены как производные этого потенциала:
S = –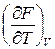 ; P = –
; P = –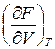 . (9.9)
. (9.9)
Изменение свободной энергии в изотермическом процессе равно работе, совершенной над системой.
Термодинамический потенциал Гиббса определяется как
G = F + PV = U – TS + PV. (9.10)
Приращение этой функции в равновесном процессе равно
dG = dF + PdV + VdP = – SdT + VdP. (9.11)
Если известна зависимость потенциала Гиббса от температуры и давления:
G (T, P), то энтропия и объем системы выражаются производными:
S = –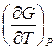 ; V =
; V = 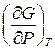 . (9.12)
. (9.12)
Потенциал Гиббса не изменяется в процессах при постоянной температуре и постоянном давлении.
Системы с переменным числом частиц. Если иметь в виду такие процессы, как испарение, плавление или химические реакции, то в число термодинамических переменных необходимо включить и число частиц системы.
Потенциал Гиббса однородной системы с постоянным числом частиц является аддитивной, т.е. пропорциональной числу частиц N (в феноменологической термодинамике количеству вещества n), функцией интенсивных переменных T и P. Поэтому для систем с переменным числом частиц его можно записать в виде произведения
G (T, P, N) = N m(T, P), (9.13)
где m(T, P) – интенсивная функция интенсивных переменных T и P, называемая химическим потенциалом. Приращение потенциала Гиббса в случае переменного числа частиц имеет вид
dG = Nd m + m dN = – SdT + VdP + m dN. (9.14)
Помимо потенциала Гиббса G (T, P, N) для однородных систем с переменным числом частиц можно ввести и другие аддитивные функции, имеющие размерность энергии. Приращение свободной энергии (F = G – PV) системы с переменным числом имеет вид
dF = dG – PdV – VdP = – SdT – PdV + m dN. (9.15)
Аналогично, приращение внутренней энергии U (S, V, N) равно
dU = dF + TdS + SdT = – TdS – PdV + m dN. (9.16)
Большой термодинамический потенциал определяется как
W = – PV = F – G = F – N m. (9.17)
Приращение большого термодинамического потенциала в равновесном процессе можно записать в виде
d W = dF – Nd m – m dN = – SdT – PdV – Nd m. (9.18)
Отсюда видно, что из функции W(T, V, m) можно определить термодинамические величины:
S = –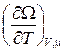 ; P = –
; P = –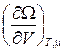 ; N = –
; N = –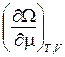 . (9.19)
. (9.19)
 2014-02-24
2014-02-24 2184
2184
