Под фазой понимают термодинамически однородную часть неоднородной системы. Например, пар и вода могут рассматриваться как две фазы одного вещества (компонента), если они являются частями одной системы.
Обычно фазы разделены поверхностью, при переходе через которую физические свойства вещества изменяются скачкообразно. Вещество в определенной фазе может состоять из пространственно разделенных частей и относиться к одной и той же фазе. Например, капельки жидкости, образующие туман, относятся к жидкой фазе, хотя поверхность, отделяющая их от газа, не является единой.
Следует обратить внимание на то, что термодинамическое понятие фазы шире, чем понятие агрегатного состояния вещества. Например, кристаллы различных модификаций относятся к различным фазам, но к одному и тому же агрегатному состоянию. Сюда же можно отнести примеры ферромагнитной и парамагнитной фаз и многие другие. Стоит отметить, что в современной физике, особенно при изучении сложных систем, понятие фазы трактуется еще шире. Например, когерентное излучение лазера может рассматриваться как новая фаза по отношению к некогерентному излучению накачки (Г.Хакен), состояние тонкой магнитной пленки с полосовой магнитной структурой и состояние со структурой цилиндрических магнитных доменов также могут рассматриваться как разные фазы.
В зависимости от условий возможно сосуществование фаз без изменения их масс. В этом случае говорят о фазовом равновесии.
Рассмотрим изолированную систему, состоящую из двух внутренне равновесных подсистем, которые представляют собой две фазы одного и того же вещества. Для этой системы имеют место условия:
U = U 1 + U 2 = const, V = V 1 + V 2 = const, N = N 1 + N 2 = const. (11.1)
В силу условий (1) изменения параметров подсистем связаны соотношениями:
dU 1 = – dU 2, dV 1 = – dV 2, dN 1 = – dN 2. (11.2)
Когда подсистемы придут в равновесие между собой, энтропия системы достигнет максимума. Поэтому будет иметь место соотношение
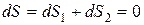 . (11.3)
. (11.3)
Подставив сюда выражения:
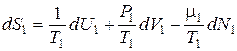 , (11.4)
, (11.4)
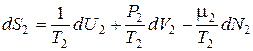 , (11.5)
, (11.5)
и учитывая (2), получаем
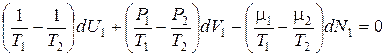 . (11.6)
. (11.6)
Так как приращения dU 1, dV 1и dN 1произвольны, условие равновесия подсистем имеют вид:
T 1= T 2; P 1= P 2; m1= m2. (11.7)
Здесь первое равенство отвечает тепловому равновесию подсистем, второе – механическому, а третье – материальному или диффузионному равновесию.
Условия равновесия (7) для двух фаз одного вещества можно записать в виде функционального равенства
m1(P, T) = m2(P, T). (11.8)
 2014-02-24
2014-02-24 1076
1076
