Вещество в состояниях, когда в равновесии находятся две его фазы, имеет всего лишь одну термодинамическую степень свободы. Если в равновесии находятся три его фазы, число степеней свободы сводится к нулю. Такие состояния называют тройными точками вещества. Условие тройной точки имеет вид
m1(P, T) = m2(P, T) = m3(P, T). (13.1)
С геометрической точки зрения это двойное равенство определяет множество точек пересечения над плоскостью PT трех поверхностей, задаваемых соответственно функциями: m1(P, T), m2(P, T) и m3(P, T).
Например, в тройной точке воды, когда в равновесии находятся лед, вода и водяной пар, давление системы равно P тр = 4,58 мм рт.ст., а температура T тр = 273,16 К. Как уже отмечалось выше, температура этого состояния используется для фиксирования термодинамической шкалы температур. Эта состояние представляется на диаграмме PT точкой, в которой сходятся кривые плавления, кипения и возгонки (см. рис.6.2).
 P
P
V
Рис. 13.1. Тройная точка воды
Тройная точка вещества, как правило, является не единственной. Они имеют место не только для пересечения кривых разделяющих твердое, жидкое и газообразное состояния вещества, но и для пересечения этих кривых с кривыми, разделяющими различные кристаллические модификации.
Фазовые переходы первого рода (кристаллизация, кипение и т.д.), совершаемые обратимым образом, описываются уравнением Клапейрона-Клаузиуса:
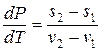 . (13.2)
. (13.2)
Так как 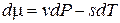 , удельный объем и удельная энтропия, которые испытывают скачок при переходах первого рода, выражаются первыми производными химического потенциала:
, удельный объем и удельная энтропия, которые испытывают скачок при переходах первого рода, выражаются первыми производными химического потенциала:
 и
и 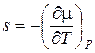 . (13.3)
. (13.3)
Поэтому уравнение Клапейрона-Клаузиса можно записать в виде
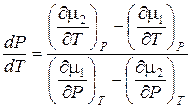 . (13.4)
. (13.4)
Фазовые переходы второго рода – фазовые превращения, происходящие без изменения удельного объема и удельной энтропии, т.е. без поглощения или выделения теплоты. К ним относятся: 1) переход вещества из ферромагнитного состояния в парамагнитное при температуре Кюри, например, a-железа в b-железо при 679° С; 2) переход вещества из обычного в сверхпроводящее состояние, например, ртуть при 4,12 К или цинк при 0,79 К; 3) переход жидкого гелия из обычного состояния (гелий I) в сверхтекучее состояние (гелий II) при 2,9 К. Уравнение Клапейрона-Клаузиуса (4) не пригодно для описания таких переходов, так как его правая часть в этом случае представляет собой неопределенность типа 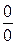 .
.
В переходах второго рода претерпевают скачок коэффициент объемного расширения 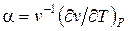 изотермическая сжимаемость
изотермическая сжимаемость 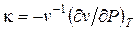 и удельная теплоемкость
и удельная теплоемкость 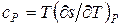 . Между ними существует связь. Чтобы установить эту связь, раскроем неопределенность в правой части уравнения (3) по правилу Лопиталя. Это можно сделать дифференцированием числителя и знаменателя по температуре:
. Между ними существует связь. Чтобы установить эту связь, раскроем неопределенность в правой части уравнения (3) по правилу Лопиталя. Это можно сделать дифференцированием числителя и знаменателя по температуре:
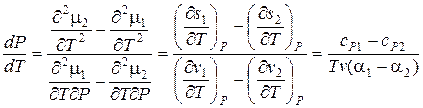 (13.5)
(13.5)
и по давлению:
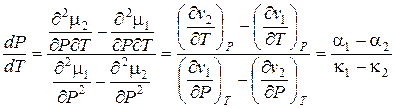 . (13.6)
. (13.6)
Таким образом, для фазовых переходов второго рода мы получили уравнения Эренфеста:
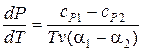 , (13.7)
, (13.7)
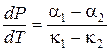 . (13.8)
. (13.8)
Приравнивая правые части (6) и (7), получаем также уравнение
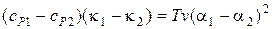 , (13.9)
, (13.9)
связывающее скачки коэффициента объемного расширения, изотермической сжимаемости и удельной изобарической теплоемкости при переходах второго рода.
 2014-02-24
2014-02-24 2019
2019
