Производство азотной кислоты из аммиака
Производство концентрированной азотной кислоты.
Производство разбавленной азотной кислоты.
Производство азотной кислоты из аммиака.
Лекция 5
СОВЕРШЕНСТВОВАНИЕ ПРОМЫШЛЕННОГО ПРОИЗВОДСТВА АЗОТА
ФЕРМЕНТАТИВНАЯ ФИКСАЦИЯ АЗОТА
Новым направлением в фиксации атмосферного азота является так называемый ферментативный метод с использованием комплексных соединений переходных металлов (железа, хрома, молибдена), в котором используется принцип естественной фиксации азота растениями в природных условиях.
2Ф-Ме + N2 ® 2Ф-МеN
2Ф-Ме + H2 ® 2Ф-МеH
Ф-МеN + 3 Ф-МеH ® NH3 + 4Ф-Ме,
где Ф-Ме – комплексное соединение металла и фермента. Процесс протекает в условиях, близких к природным, при нормальном давлении и температуре 20 °С.
Совершенствование промышленного производства аммиака идет по следующим основным направлениям:
- кооперация производства аммиака с производствами основного органического синтеза на базе использования природного газа и газов нефтепереработки;
|
|
|
- создание агрегатов большой (до 3000 т/сутки) единичной мощности;
- применение колонн синтеза с кипящим слоем катализатора;
- разработка новых катализаторов, устойчивых к ядам с низкой (300 °С температурой зажигания), позволяющих процесс синтеза без снижения выхода аммиака при низких (10 МПа) давлениях.
Азотная кислота, её свойства, промышленные сорта и области применения. Основные стадии производства азотной кислоты из аммиака. Теоретические основы окисления аммиака методом избирательного катализа. Оптимальные условия окисления аммиака до оксида азота (II). Устройство контактного аппарата поверхностного контакта. Применяемые катализаторы. Переработка нитрозных газов в разбавленную азотную кислоту. Теоретические основы процессов окисления оксида азота (II), димеризация и абсорбция оксида азота (IV). Влияние основных параметров на скорость процесса и равновесие в системе. Принципиальная схема производства разбавленной азотной кислоты комбинированным методом; его преимущества. Производство азотной кислоты, как пример технологического процесса, осуществляемого по схеме с открытой цепью. Производство концентрированной азотной кислоты. Особенности процесса. Промышленные выбросы азотнотуковых заводов и охрана окружающей среды.
Чистая (безводная) азотная кислота HNO3 при нормальной температуре – бесцветная жидкость. Tпл = 41 °С, Tкип = 86°С. Максимальную температуру кипения Ткип = 121.9 °С имеет раствор, содержащий 68.4 % HNO3, представляющий собой азеотропную смесь. Плотность при 15ºС составляет 1,52 г/см3. Азотная кислота смешивается с водой во всех отношениях и образует ряд гидратов: HNO3·H2O; HNO3·2H2O и HNO3·3H2O.
|
|
|
Разбавленная азотная кислота корродирует сталь. В связи с этим, для её транспорта и хранения применяют аппаратуру из нержавеющей стали.
Концентрированную азотную кислоту хранят и перевозят в цистернах из алюминия, на поверхности которого образуется защитный слой из оксидов алюминия.
Товарные виды азотной кислоты: промышленность выпускает три сорта разбавленной и два сорта концентрированной азотной кислоты:
разбавленная азотная кислота содержит от 45 до 60% HNO3;
концентрированная азотная кислота содержит от 97 до 98% HNO3 .
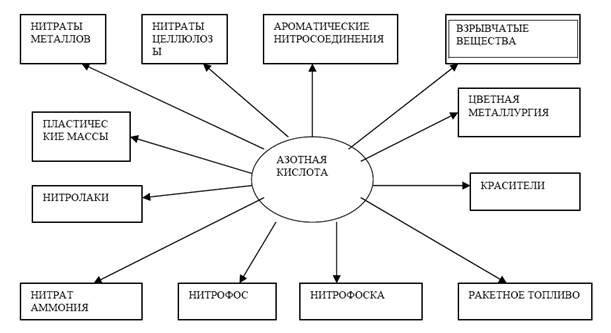
Применение. Азотная кислота по значению и масштабам применения находится на втором месте (после серной) среди минеральных кислот.
Разбавленная азотная кислота используется для производства азотных минеральных удобрений.
Концентрированная азотная кислота идёт на производство взрывчатых веществ, пластических масс, красителей и нитролаков и кинопленки.
Сырьё – в качестве сырья для производства разбавленной азотной кислоты использую аммиак. Схематически сырьевую базу для производства азотной кислоты можно представить следующим образом.
Н2 (СН4 конверсия)
↓
  N2 (воздух) ® АВС NH3 HNO3
↑ ↑
Н2 (коксовый газ) NH3 (коксовый газ) N2 (воздух) ® АВС NH3 HNO3
↑ ↑
Н2 (коксовый газ) NH3 (коксовый газ)
|
 2014-02-24
2014-02-24 1988
1988







