Лабораторная работа № 1
Определение отношения теплоемкостей 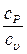 воздуха
воздуха
Цель работы. Познакомиться с понятием «теплоемкость», с их видами и связью между ними; теплоемкость смеси газов;адиабатный и политропный процессы; определить показатель адиабаты воздуха с помощью метода Клемана-Дезорма
Принадлежности Стеклянный сосуд емкостью 20 л, U-образный манометр, термометр, краны, шланги, насос (груша)
Ключевые понятия. Теплоемкость; первый закон термодинамики; внутренняя энергия; энтальпия; адиабатный и политропный процессы; метод Клемана-Дезорма.
Теплоемкость.
Теплоемкостью называется физическая величина, равная количеству теплоты, которое нужно подвести к телу или отнять у него для изменения его температуры на 1 К.
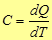 (Дж/К) (1)
(Дж/К) (1)
В зависимости от того, в каких единицах задано количество вещества, к которому подводится теплота, различают удельную массовую теплоемкость 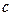 , удельную объемную теплоемкость
, удельную объемную теплоемкость 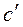 и удельную мольную теплоемкость
и удельную мольную теплоемкость 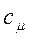 (слово «удельное» иногда опускают)
(слово «удельное» иногда опускают)
Удельная массовая теплоемкость равна отношению теплоемкости тела к его массе
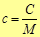 ,
, 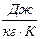 , (2)
, (2)
т.е. удельная массовая теплоемкость - это теплоемкость единицы массы вещества (1 кг)
Удельной объемной теплоемкостью называется отношение теплоемкости тела к его объему при нормальных условиях (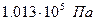 и
и 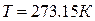 )
)
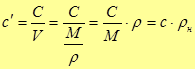 ,
, 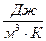 (3)
(3)
где 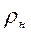 - плотность вещества (газа) при нормальных условиях.
- плотность вещества (газа) при нормальных условиях.
Таким образом, объемная теплоемкость – это теплоемкость массы вещества, содержащегося в 1 м3 при нормальных условиях.
Удельная мольная (молярная) теплоемкость - это теплоемкость количества вещества, равного его молярной массе 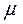 . Молярная теплоемкость связана с массовой очевидным соотношением
. Молярная теплоемкость связана с массовой очевидным соотношением
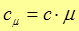 ,
, 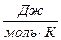 , (4)
, (4)
Для газов теплоемкость существенно зависит от характера процесса. Большое значение в теории и в практике имеют теплоемкости при постоянном объеме 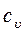
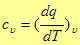 (5)
(5)
и при постоянном давлении 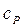
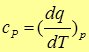
 (6)
(6)
Из первого закона термодинамики для единицы массы
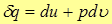 (7)
(7)
следует, что при постоянном объеме 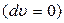 работа расширения равна нулю, и все подведенное тепло идет на изменение внутренней энергии системы
работа расширения равна нулю, и все подведенное тепло идет на изменение внутренней энергии системы
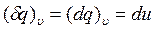 (8)
(8)
Подставив (8) в (5) получим для удельной теплоемкости при постоянном объеме
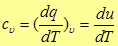 (9)
(9)
Отсюда имеем
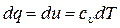 (10)
(10)
В предположении 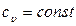 интегрирование (10) дает
интегрирование (10) дает
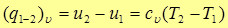 (11)
(11)
т.е. изменение внутренней энергии идеального газа в изохорном процессе равно количеству теплоты, которые, в свою очередь, равно произведению теплоемкости 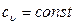 на разность температур в конце и в начале процесса.
на разность температур в конце и в начале процесса.
Поскольку внутренняя энергия идеального газа зависит только от температуры (закон Джоуля), то для любого процесса, а не только для процесса 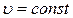 , справедливо
, справедливо
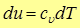
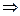
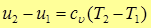 (12)
(12)
При постоянном давлении величину 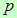 во втором слагаемом в выражении (7) можно ввести под знак дифференциала
во втором слагаемом в выражении (7) можно ввести под знак дифференциала
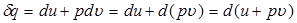 (13)
(13)
Величина, стоящая в скобках, играет важную роль в термодинамике. Она введена У. Гибссом (амер. физик, 1839-1908) и названа (Камерлинг-Онесс, голландский физик, открыл явление сверхпроводимости) энтальпией.
Итак, энтальпия системы равна сумме ее внутренней энергии 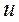 и произведения
и произведения 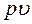 :
:
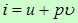 (14)
(14)
Для произвольной массы газа
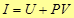 (15)
(15)
Так как 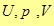 - функции состояния, тоэнтальпия также будет функцией состояния. Энтальпия измеряется в единицах энергии
- функции состояния, тоэнтальпия также будет функцией состояния. Энтальпия измеряется в единицах энергии 
Величина 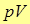 называется работой проталкивания, и представляет собой работу, которую необходимо затратить, чтобы ввести тело объемом
называется работой проталкивания, и представляет собой работу, которую необходимо затратить, чтобы ввести тело объемом 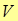 во внешнюю среду, имеющую давление
во внешнюю среду, имеющую давление 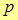
Поясним разницу между внутренней энергией и энтальпией. Внутренняя энергия включает энергию хаотического (теплового) движения всех микрочастиц системы (молекул, атомов, ионов и т.д.) и энергию их взаимодействия. Кинетическая энергия движения системы как целого и ее потенциальная энергия во внешних силовых полях во внутреннюю энергию не входит. Внутренняя энергия есть собственная энергия тела, присущая ему как таковому; она не зависит от внешней сред. Напротив, энтальпия учитывает наличие внешней среды, с которой система взаимодействует. Это взаимодействие отражается слагаемым 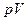 в уравнениях (13-15). Величина
в уравнениях (13-15). Величина 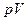 представляет собой работу,которую нужно было затратить для того,чтобы ввести тело объемом
представляет собой работу,которую нужно было затратить для того,чтобы ввести тело объемом 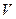 в среду, имеющую давление
в среду, имеющую давление 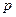
Проиллюстрируем сказанное. Пусть имеется цилиндр, под поршнем которого находится газ при давлении 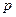 (рис.1).Для уравновешивания этого давления поршень площадью
(рис.1).Для уравновешивания этого давления поршень площадью 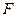 должен быть нагружен сверху грузом весом
должен быть нагружен сверху грузом весом 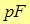 Тогда полная энергия газа под поршнем равна сумме внутренней энергии
Тогда полная энергия газа под поршнем равна сумме внутренней энергии 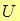 и потенциальной энергии груза на высоте
и потенциальной энергии груза на высоте 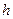 (над дном цилиндра)
(над дном цилиндра) 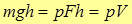 , т.е.
, т.е. 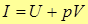 ; эта величина и есть энтальпия.
; эта величина и есть энтальпия.
При поднимании поршня от дна цилиндра на высоту 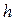 происходит протолкивание (выталкивание, вытеснение) объема газа за пределами цилиндра, равного изменению объема газа в цилиндре. Говоря по другому, среда за пределами объема под поршнем занимает все доступное ей пространство и противодействует попытккам занять в ней место другим телам.
происходит протолкивание (выталкивание, вытеснение) объема газа за пределами цилиндра, равного изменению объема газа в цилиндре. Говоря по другому, среда за пределами объема под поршнем занимает все доступное ей пространство и противодействует попытккам занять в ней место другим телам.
 | |||||
 |  | ||||






|
|
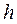

Рис. 1К вопросу о работе проталкивания
Продифференцируем (14)
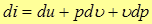 (16)
(16)
Выразив отсюда величину
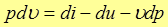
и подставив ее в (7), получим еще один вид первого закона термодинамики
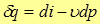 (17)
(17)
Если газ нагревается при постоянном давлении (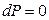 ), то подведенное тепло в соответствии с выражением (17) идет на приращение энтальпии
), то подведенное тепло в соответствии с выражением (17) идет на приращение энтальпии
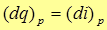 (18)
(18)
Или 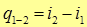 (19)
(19)
Отсюда вытекает физический смысл энтальпии: в изобарных процессах изменение энтальпии равно количеству теплоты, поглощенной или отданной системой.
Подставив (18) в (6), имеем 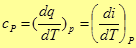
Если подставить сюда выражение для энтальпии
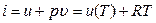
то получим соотношение, называемое уравнением Майера.
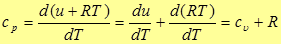 (20)
(20)
Видно, что теплоемкость при постоянном давлении больше теплоемкости при постоянном объеме на величину газовой постоянной для данного вещества. Это объясняется тем, что не все подведенное тепло в процессе при 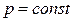 идет на изменение внутренней энергии –некоторая часть тепла тратится на совершение работы вследствие изменения объема.
идет на изменение внутренней энергии –некоторая часть тепла тратится на совершение работы вследствие изменения объема.
Важное значение в термодинамике играет величина, равная отношению теплоемкостей при постоянном давлении и постоянном объеме, которая называется показателем адиабаты (постоянной адиабаты, постоянной Пуассона)
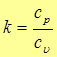 (21)
(21)
Если взять опытные значения теплоемкостей 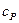 и
и 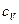 и вычислить их отношения, то окажется, что оно приблизительно одинаково для газов с одинаковым числом атомов в молекуле, а именно
и вычислить их отношения, то окажется, что оно приблизительно одинаково для газов с одинаковым числом атомов в молекуле, а именно
Таблица 1
| Число атомов в молекуле | Показатель адиабаты, 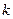 |
| 1.66 | |
| 1.4 | |
| 3 и более | 1.33 |
Для одно- и двухатомных газов это правило выполняется достаточно точно; для трехатомных отклонения оказываются более заметными.
Согласно молекулярно - кинетической теории на каждую степень свободы движения молекулы приходится в среднем 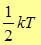 энергии. Тогда полная энергия молекулы будет равна произведению числа степеней свободы
энергии. Тогда полная энергия молекулы будет равна произведению числа степеней свободы 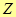 на указанную величину
на указанную величину
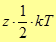 (22)
(22)
где 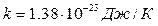 - постоянная Больцмана.
- постоянная Больцмана.
Энергия одного моля будет равна произведению числа Авогадро 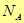 на энергию одной молекулы.
на энергию одной молекулы.
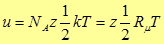 (23)
(23)
где 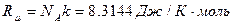 - универсальная газовая постоянная.
- универсальная газовая постоянная.
Выражение (23) дает внутреннюю энергию одного моля идеального газа. Тогда молярная теплоемкость при постоянном объеме будет
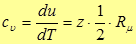 (24)
(24)
Двухатомная жесткая молекула имеет пять степеней свободы 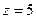 Трехатомная и более сложная молекула может вращаться вокруг всех трех осей и имеет соответственно шесть степеней свободы:
Трехатомная и более сложная молекула может вращаться вокруг всех трех осей и имеет соответственно шесть степеней свободы: 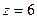
Используя уравнение Майера, можем написать для теплоемкости 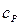
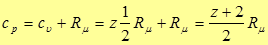 (25)
(25)
Теперь отношение теплоемкостей будет 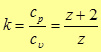 (26)
(26)
Подставив сюда значения 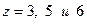 , получим теоретические значения для показателя адиабаты, совпадающие с опытными результатами в таблице 1.
, получим теоретические значения для показателя адиабаты, совпадающие с опытными результатами в таблице 1.
Таблица 2
| Число атомов в молекуле | Число степеней свободы, 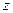 | Показатель адиабаты, 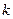 |
| 1.66 | ||
| 1.4 | ||
| 3 и более | 1.33 |
Совпадение с экспериментальными данными в таблице 1 довольно хорошее.
Теплоемкость идеального газа может зависеть от температуры, а реального- и от давления. В связи с этим водятся понятия «истинная» и «средняя» теплоемкости.
Истинной теплоемкостью называется отношение элементарного количества теплоты 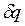 , сообщенной системе, к бесконечно малому изменению температуры
, сообщенной системе, к бесконечно малому изменению температуры 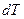
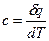 (27)
(27)
Средней теплоемкостью данного процесса в интервале температур от 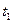 до
до 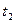 называется отношение количества теплоты
называется отношение количества теплоты 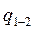 , переданного в процессе, к конечной разности температур
, переданного в процессе, к конечной разности температур 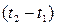
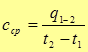 (28)
(28)
Количество теплоты можно найти интегрированием выражение (27)
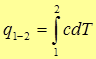 (29)
(29)
где 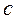 - истинная удельная теплоемкость.
- истинная удельная теплоемкость.
Подставляя (29) в (28), получим
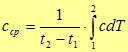 (30)
(30)
В большинстве случаев, особенно при расчете процессов сгорания, где температуры высоки, а давления имеют порядок атмосферного, практически можно пренебречь зависимостью теплоемкости от давления, и учитывать лишь ее изменение с температурой, и кроме этого, допустимо применение уравнения состояния идеального газа
Теплоемкости всех индивидуальных веществ сводят в таблицы. Пользуясь этими таблицами можно определить теплоемкости различных смесей. Если смесь задана массовыми долями 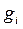
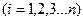 компонентов, или объемными долями
компонентов, или объемными долями 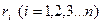 , то удельная
, то удельная 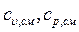 и объемная
и объемная 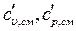 теплоемкости смеси будут определятся соответственно по формулам
теплоемкости смеси будут определятся соответственно по формулам
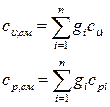
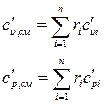 (31)
(31)
где 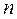 - число компонентов.
- число компонентов.
 2015-05-06
2015-05-06 5437
5437