Важно знать и понимать, каким образом осуществляются переходы между агрегатными состояниями веществ. Схему таких переходов изобразим на рисунке 4.
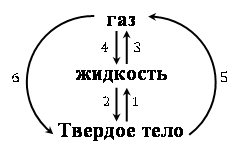
1 – плавление;
2 – отвердевание (кристаллизация);
3 – парообразование: испарение или кипение;
4 – конденсация;
5 – сублимация (возгонка) – переход из твердого состояния в газообразное, минуя жидкое;
6 – десублимация – переход из газообразного состояния в твердое, минуя жидкое.
Б. 2 Плавление льда и замерзание воды (кристаллизация)
Если поместить лед в колбу и начать его нагревать с помощью горелки, то можно будет заметить, что его температура начнет повышаться, пока не достигнет температуры плавления (0oC). Затем начнется процесс плавления, но при этом температура льда повышаться не будет, и только после окончания процесса плавления всего льда температура образовавшейся воды начнет повышаться.
Определение. Плавление – процесс перехода из твердого состояния в жидкое. Этот процесс происходит при постоянной температуре.
Температура, при которой происходит плавление вещества, называется температурой плавления и является измеренной величиной для многих твердых веществ, а потому табличной величиной. Например, температура плавления льда равна 0oC, а температура плавления золота 1100oC.
Обратный плавлению процесс – процесс кристаллизации – также удобно рассматривать на примере замерзания воды и превращения ее в лед. Если взять пробирку с водой и начать ее охлаждать, то сначала будет наблюдаться уменьшение температуры воды, пока она не достигнет 0oC, а затем ее замерзание при постоянной температуре), и уже после полного замерзания дальнейшее охлаждение образовавшегося льда.
Если описанные процессы рассматривать с точки зрения внутренней энергии тела, то при плавлении вся полученная телом энергия расходуется на разрушение кристаллической решетки и ослабление межмолекулярных связей, таким образом, энергия расходуется не на изменение температуры, а на изменение структуры вещества и взаимодействия его частиц. В процессе же кристаллизации обмен энергиями происходит в обратном направлении: тело отдает тепло окружающей среде, а его внутренняя энергия уменьшается, что приводит к уменьшению подвижности частиц, увеличению взаимодействия между ними и отвердеванию тела.
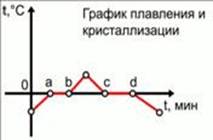 График плавления и кристаллизации
График плавления и кристаллизации
Полезно уметь графически изобразить процессы плавления и кристаллизации вещества на графике. По осям графика расположены: ось абсцисс – время, ось ординат – температура вещества. В качестве исследуемого вещества примем лед при отрицательной температуре, т. е. такой, который при получении тепла не начнет сразу плавиться, а будет нагревать до температуры плавления. Опишем участки на графике, которые представляют собой отдельные тепловые процессы:
Начальное состояние – a: нагревание льда до температуры плавления 0oC;
a – b: процесс плавления при постоянной температуре 0oC;
b – точка с некоторой температурой: нагревание образовавшейся из льда воды до некоторой температуры;
Точка с некоторой температурой – c: охлаждение воды до температуры замерзания 0oC;
c – d: процесс замерзания воды при постоянной температуре 0oC;
d – конечное состояние: остывание льда до некоторой отрицательной температуры.
 2014-02-24
2014-02-24 10726
10726








