Для определения конкретных физических условий, в которых находится термодинамическая система, используют ряд показателей, называемых параметрами состояния. В число основных параметров входят: абсолютная температура, абсолютное давление и удельный объем.
Абсолютная температура –– это мера кинетической энергии движения молекул. Она характеризует тепловое состояние тела. Температуру измеряют по абсолютной шкале в градусах Кельвина (К) и обозначают буквой Т, либо по Международной практической системе единиц в градусах Цельсия (°С) и обозначают t. В качестве реперной точки этих двух температур взята тройная точка чистой воды, при которой все три фазы воды (лед, вода и пар) находятся в равновесии друг с другом. Температура в такой точке соответствует значениям 273,15 К и 0,01°С. Таким образом, связь между единицами измерения температуры в Кельвинах и Цельсиях можно выразить:
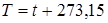 .
.
Абсолютное давление –– это средняя сила, с которой молекулы вещества действуют на единицу площади сосуда. Обозначают абсолютное давление буквой р. Измеряют давление в ньютонах деленных на квадратный метр Н/м2 или в паскалях Па (1Н/м2 =1Па). Так как эти единицы измерения для практических целей очень малы, то давление может измеряться в барах (1бар = 105Па). В технической системе (МКГСС) за единицу силы принимают килограмм-силу (кгс), тогда единица измерения давления может быть выражена кгс/м2 (1кгс/м2 = 9,8 Па). Эта единица измерения также мала, поэтому в технической системе за единицу измерения давления принимают техническую атмосферу ат тех. (1 ат тех. = 104 кгс/м2 = 1кгс/см2 = 0,98 бар). Давление также измеряю высотой столба жидкости. Например:
1 ат тех = 735 мм рт. ст. = 10 м вод. ст. (при 0°С).
Следует сказать, что под действием давления и температуры столб жидкости может менять свой объем, поэтому давление рабочего тела жидкостным столбом измеряют при нормальных физических условиях (760 мм рт. ст. и 0 °С). В этом случае атмосферу называют физической.
1 ат физ. = 1,033 ат тех. = 760 мм рт. ст. = 101,3 кПа = 10,33 м вод. ст.
Под абсолютным давлением понимают действительное давление рабочего тела внутри сосуда. Давление жидкостей, паров или газов обычно измеряют приборами барометрического типа, приборами манометрического типа и вакуумметрами. Барометры измеряют давление окружающей среды В. Манометры меряют разность между абсолютным давлением в сосуде и давлением в окружающей среды, то есть избыточное давление р и. Следовательно, когда давление в сосуде превышает давление среды, абсолютное давление рабочего тела будет определяться:
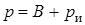 .
.
Вакуумметры показывают разность давления окружающей среды и абсолютного давления в сосуде, то есть разряжение или вакуум р в. В этом случае абсолютное давление можно найти:
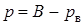 .
.
Удельный объем –– это объем, занимаемый рабочим телом массой 1 кг. Удельный объем обозначают буквой v и измеряют в кубических метрах деленных на килограмм (м3/кг). Если V это объем тела, м3, занимаемый массой М, кг, то 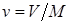 .
.
Обратной величиной удельному объему является плотность ρ (кг/м3): v = 1/ρ или v ∙ρ =1.
В каждом конкретном случае все параметры состояния рабочего тела однозначно связаны друг с другом. Зная эту зависимость и задавшись какими-либо двумя параметрами, можно найти остальные неизвестные параметры. Метод их определения зависит от того, в каком виде –– аналитическом, графическом или табличном –– представлена эта зависимость.
Аналитическая зависимость параметров состояния представляет собой уравнение состояния. Для идеального газа используется уравнение Менделеева-Клапейрона.
Для 1 кг газа оно запишется:
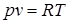 .
.
Для газа массой М кг это уравнение примет вид:
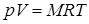 .
.
Для 1 киломоля газа: 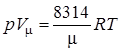 ,
,
где R –– газовая постоянная, независящая от состояния газа, Дж/(кг∙К); V μ –– объем 1 киломоля газа, м3/кмоль; μ –– молярная масса газа, кмоль.
Для многих реальных газов уравнение состояния имеет очень громоздкий вид и для расчетов такое уравнение трудно использовать. Поэтому параметры состояния реальных газов, а также жидкостей определяют табличным или графическим способом.
В таблицах заносят массив значений параметров состояния вещества, из которого выбираются искомые значения при заданных двух параметрах состояния (обычно при температуре и давлении).
Для графического определения параметров состояния используют p-v, T-S и i-S диаграммы. На этих диаграммах наносят семейства изобар, изохор, изотерм и адиабат. Одно из свойств таких диаграмм состоит в том, что каждому состоянию рабочего тела соответствует точка на диаграмме. Для рассчитываемого состояния она лежит на пересечении линий двух исходных параметров.
При подводе одного итого же количества теплоты к различным телам они изменяют свою температуру на разную величину. Это происходит вследствие того, что тела обладают разной теплоемкостью. Теплоемкостью называют количество теплоты, которое необходимо сообщить телу, чтобы изменить его температуру на 1 градус.
В зависимости от того, в каких единицах задано количество вещества теплоемкость различают: массовую с кДж/(кг∙К); объемную с / кДж/(м3∙К); молярную с μкДж/(кмоль∙К).
Связь между ними выражается следующей зависимостью:
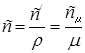 .
.
Если –– q количества тепла, сообщаемого единице количества газа при изменении температуры газа от Т 1 до Т 2 то величина
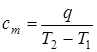
будет представлять собой среднюю теплоемкость в пределах Т 1 – Т 2.
Тогда количество сообщенной телу теплоты будет определяться:
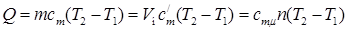 ,
,
где т –– масса газа, кг; V н –– объем газа приведенный к нормальным физическим условиям, м3; п –– число молей газа.
 2014-02-24
2014-02-24 8055
8055
