Окислением фосфора в недостатке кислорода
Легко окисляется на воздухе со свечением
Реагирует со щелочами
С горячей водой реагирует быстро
Медленно растворяется в холодной воде
P2O3 + H2O → H3PO3 фосфористая кислота
P2O3 + H2O t→ P↓ + PH3↑ + H3PO4 фосфорная кислота
P2O3 + NaOH → Na2HPO3 + H2O
Так как фосфористая кислота – двухосновная, то в подобных реакциях замещается только два атома водорода.
Na3PO3 в таких реакциях не образуется.
P2O3 + O2 → P2O5
Соединения P+3 – сильные восстановители, окисляются до Р+5. ОЧЕНЬ ЯДОВИТЫ.
ПОЛУЧЕНИЕ P2O3
P + O2 → P2O3
P + N2O t→ P2O3 + N2
ФОСФОРНЫЙ АНГИДРИД P2O5
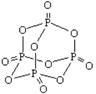 Истинная формула фосфористого ангидрида – Р4О10
Истинная формула фосфористого ангидрида – Р4О10
ФИЗИЧЕСКИЕ СВОЙСТВА P2O5
P2O5 – белый кристаллический порошок. Возгоняется при 360 °С. Очень сильно поглощает влагу.
ХИМИЧЕСКИЕ СВОЙСТВА P2O5
1) Взаимодействует с водой. В зависимости от количества воды образуются разные кислоты
P2O5 + H2O → 2HPO3 метафосфорная кислота
P2O5 + 2H2O → H4P2O7 пирофосфорная кислота
P2O5 + 3H2O → 2H3PO4 ортофосфорная кислота
При разбавлении водой стекловидная масса метафосфорной кислоты превращается в ортофосфорную кислоту:
HPO3 + 3H2O → H3PO4
 2014-02-09
2014-02-09 3634
3634
