Известно, что электронная структура атома характеризуется дискретным спектром разрешённых значений энергий электронов: энергетический спектр энергий отдельного атома находится из решения стационарного уравнения Шредингера. Известно, что точное решение нахождения спектра энергий многоэлектронного атома не существует, однако хорошим приближением, которое достаточно точно описывает электронную структуру и химические свойства атомов, является одноэлектронное приближение. Основу этого приближения представляет точное решение уравнения Шредингера для атома водорода, согласно которому электронная структура атома определяется тремя квантовыми числами: главным квантовым число n = 1, 2, …, орбитальным квантовым числом l = 0, 1, … (n - 1) и магнитным квантовым числом m = 0, ± 1, …, ± l.
Главное квантовое число определяет спектр энергий водородоподобного атома по формуле:
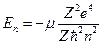
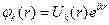 где
где 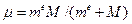 - приведённая масса атома, Z – заряд ядра. Орбитальное и магнитное квантовые числа определяют заполнение квантовых состояний в соответствии с принципом Паули (в одном квантовом числе nlm может быть не более двух электронов с противоположными значениями спина ±
- приведённая масса атома, Z – заряд ядра. Орбитальное и магнитное квантовые числа определяют заполнение квантовых состояний в соответствии с принципом Паули (в одном квантовом числе nlm может быть не более двух электронов с противоположными значениями спина ±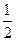 ) и эмпирическим правилом Хунда, согласно которому электроны занимают квантовые состояния так, чтобы реализовать максимально возможное значение суммарного спина системы.
) и эмпирическим правилом Хунда, согласно которому электроны занимают квантовые состояния так, чтобы реализовать максимально возможное значение суммарного спина системы.
Каждое электронное квантовое состояние характеризуется волновой функцией φlm (r), квадрат модуля которой определяет пространственное распределение электронной плотности. Характерный вид этих распределений для различных l и m показан на рис.
s – электроны p – электроны, l = 1
(l = 0, m = 0) m = 1 m = 0 m = +1 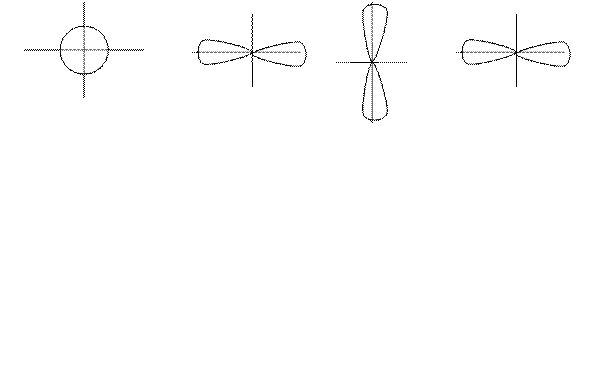
d – электроны, l = 2
m = -2 m = -1 m = 0 m = 1 m = 2
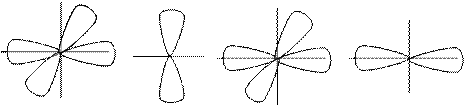 | |||||
 | |||||
 |
f – электроны, l = 3
m = -3 m = 2 m = -1 m = 0 m = +1 m = +2 m = +3
 2014-02-09
2014-02-09 421
421








