НАНОРАЗМЕРНОЕ СОСТОЯНИЕ ВЕЩЕСТВА
Эксимеры
Возбужденные состояния двух одинаковых молекул, не образующих комплекс в основном состоянии. Наблюдается только по возникающей длинноволновой люминесценции и (или) по тушению мономолекулярной люминесценции.
Триплет-?
(курс лекций)
Разнообразие окружающих нас веществ и материалов в живой и неживой природе, многочисленное множество свойств и функций, которые они выполняют, обусловлено их сложной иерархической структурной организацией. На рис. 1 показаны четыре иерархических уровня структурной организации: атомарный, молекулярный, супрамолекулярный и клеточный. Каждый уровень структурной организации характеризуется своим масштабом размеров и различными значениями энергий связи структурных единиц, составляющих вещество.
Все вещества cостоят из атомов, атомы за счет химических связей объединяются в молекулы различной степени сложности: от простых двухатомных до гигантских полимерных молекул. Если энергия связи индивидуального атома имеет значения порядка 103 электрон-вольт для ядерных взаимодействий, определяющих состав ядра атома, и 106 электрон-вольт для кулоновских взаимодействий электронного остова атома с его ядром, то энергия химических связей, объединяющих атомы в индивидуальные молекулы, составляет уже единицы электрон-вольт. Масштабы энергий межмолекулярных взаимодействий, играющих очень важную роль при формировании функциональных свойств вещества, соответствуют десятым долям электрон-вольта и даже зачастую приближаются к энергии теплового движения.
Таким образом, вещество, обладающее определенным набором физико-химических свойств, можно построить различными способами.
Самый простой способ использует только один уровень структурной организации – вещество собирается из отдельных атомов, причем каждый атом участвует в этой сборке как индивидуальная независимая частица. Характерный размер атомов порядка ангстрема или нескольких десятых нанометра и соответственно характерный масштаб размеров, на котором происходит структурирование вещества, также находится в этих пределах.

|
Более сложный способ использует два структурных уровня. Сначала атомы собираются в индивидуальные молекулы, а затем молекулы образуют структуру вещества. При этом атом выступает не как индивидуальная структурная единица, а как составная часть другой более сложной структурной единицы – молекулы. В этом случае характерный размер базовой структурной единицы вещества – молекулы, составляет величину порядка одного нанометра, а иногда и больше.
Третий способ сборки вещества - это когда индивидуальная структурная единица вещества имеет размер порядка нанометров или даже нескольких десятков нанометров. В этом случае индивидуальная структурная единица представляет собой, как правило, упорядоченную сборку, составленную, по крайней мере, из нескольких десятков (а иногда и сотен) отдельных молекул. Этот уровень организации мы будем называть наноразмерным или супрамолекулярным уровнем.
В живой природе возникает еще более сложный - клеточный уровень, состоящий в том, что различные по своему строению и составу наноразмерные системы объединяются в клеточные структуры, имеющие характерный размер от сотен до нескольких десятков сотен нанометров.
По сложности структурной организации все вещества можно условно разделить на простые и сложные (рис. 1). Простые вещества имеют не более двух иерархических структурных уровня организации. Например, золото является простым веществом, структуру которого можно представить в виде упорядоченной плотной упаковки твердых шаров радиуса 0,144 нм. Центры шаров занимают узлы гранецентрированной кубической кристаллической решетки (рис. 2).
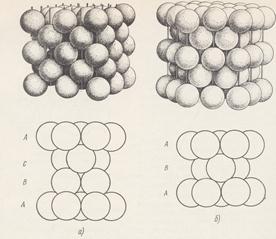 Рис 2. Рис 2. | Каждый атом имеет 12 ближайших соседних атома, находящихся на расстоянии 0,288 нм. Таким образом, данный пример демонстрирует самый простой способ сборки вещества, с использованием только одного атомарного уровня организации. При этом межатомное взаимодействие имеет ненаправленный изотропный характер. |
Это обусловлено тем, что все валентные электроны в кристалле обобществляются, и кристаллическая решетка металлического вещества стягивается в плотно упакованную структуру за счет взаимодействия положительно заряженного атомного остова решетки с электронной ферми-жидкостью, в которую она погружена.
Другой пример – монокристалл алмаза, который представляет собой регулярную кристаллическую решетку, построенную только из атомов углерода. С точки зрения химического состава алмаз – это вещество, состоящее из одного химического элемента – углерода, а с точки зрения структурной организации атомы углерода в алмазе образуют регулярную кристаллическую решетку так, что каждый атом связан с четырьмя другими ковалентными связями длиной 0,14 нм и углы, между которыми равны 109028’(рис.2).  Таким образом, индивидуальной структурной единицей алмаза является координационный тетраэдр составленный из пяти атомов углерода (рис. 3), в котором центральный атом, имеющий четыре ненасыщенных химических связи и находящийся в центре тетраэдра, ковалентно связан с 4-мя атомами, расположенными в вершинах тетраэдра. Также устроена кристаллическая решетка кремния, германия, серого олова. Уровень организации этих веществ является атомарным, т.е. вещество построено из атомов, которые расположены в узлах регулярной кристаллической решетки.
Таким образом, индивидуальной структурной единицей алмаза является координационный тетраэдр составленный из пяти атомов углерода (рис. 3), в котором центральный атом, имеющий четыре ненасыщенных химических связи и находящийся в центре тетраэдра, ковалентно связан с 4-мя атомами, расположенными в вершинах тетраэдра. Также устроена кристаллическая решетка кремния, германия, серого олова. Уровень организации этих веществ является атомарным, т.е. вещество построено из атомов, которые расположены в узлах регулярной кристаллической решетки.
Атомарный уровень структурной организации вещества соответствует масштабу порядка 10-10 м. 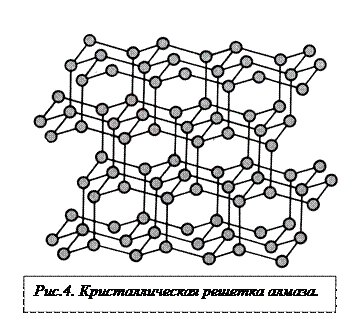 Число различных индивидуальных структурных единиц атомарного масштаба составляет величину порядка 102. Фактически это число различных элементов в периодической таблице Менделеева.
Число различных индивидуальных структурных единиц атомарного масштаба составляет величину порядка 102. Фактически это число различных элементов в периодической таблице Менделеева.
Следующий размерный уровень – это молекулярный уровень. Его размерный масштаб определяется размером индивидуальной молекулы, состоящей из нескольких (или, для больших молекул из нескольких десятков) атомов, как правило, жестко связанных химическими связями, которые однозначно определяют пространственную структуру молекулы. Ситуация усложняется если некоторые химические связи допускают вращение отдельных фрагментов молекулы, что приводит к существованию нескольких изомерных форм одной и той же молекулы. Число различных индивидуальных структур видов молекулярного масштаба теоретически может быть очень велико, что следует из простого комбинаторного подсчета, сколько можно построить молекул их имеющихся в природе атомов. Число известных на сегодня различных видов молекул составляет примерно 106, из них число наиболее распространённых в природе молекулярных структур примерно на два порядка меньше.
Сложные по структуре вещества по нашему определению как минимум должны быть построены из молекул, при этом тут наверно трудно указать какой-либо количественный критерий, позволяющий дифференцировать простые и сложные вещества. Возьмем, к примеру, воду в твердом агрегатном состоянии. Известно, что 3-х атомная молекула воды может образовывать десять различных кристаллических фазовых состояний, а также аморфную фазу. Структура обычного атмосферного льда такова, что атомы кислорода образуют регулярную гексагональную решетку, т.е. каждый атом кислорода имеет 4 ближайших соседа, с которыми он связан посредством 4 протонов, причем 2 из них участвуют в образовании обычной ковалентной связи в молекуле воды, а 2 других образуют водородную связь между разными молекулами воды. Расположение этих протонов необязательно одинаково во всех элементарных ячейках кристалла (рис. 5). Другими словами атомы водорода уже не образуют регулярную кристаллическую решетку. Они располагаются случайным образом, занимая в координационном тетраподе одну из двух позиций – либо ближнюю позицию к центральному атому кислорода (ковалентная связь), либо дальнюю позицию (водородная связь). Можно показать, что число возможных «водородных» конфигураций такой кристаллической решетки, состоящей из N молекул воды, составляет (3/2)N. Этот пример показывает сложность строения вещества, даже в случае такой простой молекулы как вода.
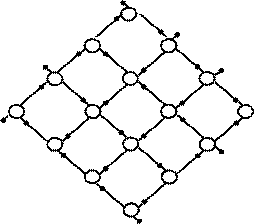
Рис. 5. 2-х мерная проекция кристаллической решетки льда, демонстрирующая «ледовый беспорядок» в расположении атомов водорода.
 2014-02-09
2014-02-09 887
887







