Политропный процесс описывается уравнением
p1 v1 n = p2 v2 n .
Для данного процесса показатель политропы п является величиной постоянной.
Из уравнения политропы и уравнения состояния нетрудно получить выражения, устанавливающие связь между р, v и Т влюбых двух точках на политропе.
Внешняя работа процесса
lвнеш = (n – 1) -1(p1v1 – p2v2).
lрасп = nlвнеш.
Количество подведенной (или отведенной) в процессе теплоты можно определить с помощью уравнения первого закона термодинамики:
q = cnол (T2 – T1),
где теплоёмкость политропного процесса
cnол = cv (n – k) / (n – 1).
При постоянных с v, k и п теплоемкость cnол = const.
 |
| |||||||||||||||||||||||||||||||||
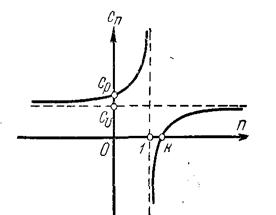
| Рис. 4.5. Зависимость теплоёмкости от показателя политропы | Рис.4.6. Значения теплоёмкостей для разных процессов |
На рис. 4-5 приведена зависимость теплоёмкости от показателя политропы, из которого следует, что при n = 1 функция теплоёмкости терпит разрыв, при n < 1 теплоёмкость положительна, в интервале 1< n < k – отрицательна, а при n > k – вновь положительна.
Изменение внутренней энергии
Δu = cv (Т2 – Т1).
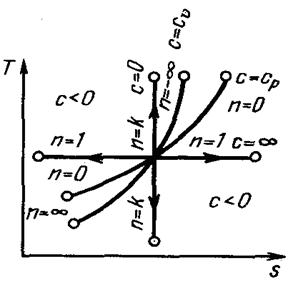 |
| Рис. 4.7. Изображение основных термодинамических процессов идеального газа в Т, s-координатах |
Изменение энтальпии
Δi = cp (T2 – T1).
Изменение энтропии
Δs = cnол ln(T2 / T1).
Политропный процесс имеет обобщающее значение, ибо охватывает совокупность четырёх основных термодинамических процессов.
На рис. 4.7 показано взаимное расположение на Т, s-диаграммах политропных процессов с разными значениями показателя политропы. Все процессы начинаются в одной точке («в центре»).
Адиабата и изотерма делит поле диаграммы на четыре квадранта. Изохора (п= ± оо) и изобара проходят через второй и четвёртый квадранты. Процессы, находящиеся правее изохоры, характеризуются положительной работой, так как сопровождаются расширением рабочего тела; для процессов, расположенных левее изохоры, характерна отрицательная работа.
Процессы, расположенные правее адиабаты, идут с подводом теплоты к рабочему телу; процессы, лежащие левее адиабаты, протекают с отводом теплоты.
Для процессов, расположенных над изотермой (n = 1), характерно увеличение
внутренней энергии газа; процессы, расположенные под изотермой, сопровождаются уменьшением внутренней энергии.
Процессы, расположенные между адиабатой и изотермой, имеют отрицательную
теплоемкость, так как q и du (а следовательно, и dT), имеют в этой области противоположные знаки. В таких процессах | l | > | q |, поэтому на производство работы при расширении тратится не только подводимая теплота, но и часть внутренней энергии рабочего тела.
Исторически политропная модель термодинамического процесса возникла в конце XIX столетия как результат обобщения классических термодинамических процессов, открытых в XVII – XIX столетиях. Обобщённая модель была получена путём формального распространения значений показателей степени конкретных процессов на числовую ось ± ∞ при сохранении условия с = пост.
Давно установлено, что применительно к ДВС уравнения политропных процессов лишь приближённо отражают особенности реальных процессов сжатия и расширения и совсем не годятся для описания процесса сгорания. Во всех учебных пособиях много места занимают объяснения причин отклонений в протекании политропных и реальных процессов.
Объяснить несовершенство для применения при расчётах процессов в ДВС, основное развитие которых относится к значительно более позднему периоду, можно, главным образом, несоответствием характером подвода и отвода теплоты от рабочего тела при политропном и реальном процессе.
Широко освоенный метод определения показателя политропы n по индикаторным диаграммам [12], показал, что показатель n является переменной величиной, как в процессе сжатия, так и в процессах сгорания и расширения.
Сравнение показателя политропы с показателем адиабаты позволило объяснять динамику тепловых потоков в течение отдельных процессов реального цикла, которая противоречила расчётам по уравнениям политропных процессов. Иллюстрацией могут служить данные, полученные при индицировании четырехтактного компрессорного тихоходного двигателя с самовоспламенением (n = 226 об/мин, ε = 14) производства фирмы Зульцер и приведенные в изданном в 1953 году учебном пособии Мелькумова [16]). На графике рис. 1 приведена индикаторная диаграмма, там же нанесены кривые переменных значений показателя n1 на ходе сжатия и показателя n2 линии конечной фазы сгорания и фазы расширения.
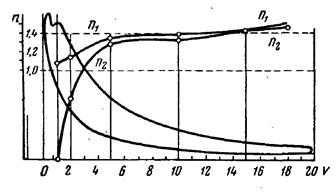 |
| Рис. 1. Изменение показателей политроп для линий сжатия и расширения в четырехтактном двигателе Зульцер. |
Плавное протекание кривой n свидетельствует о плавном переходе при расширении от одного термодинамического процесса к другому: вблизи от ВМТ (участок) величина n2 близка к нулю, что соответствует изобарному процессу. Затем величина n2 достигает единицы, что свидетельствует о наличии на диаграмме изотермного участка, соответствующего максимуму температуры. Согласно политропной модели в этой точке тепловой поток меняет знак с положительного на отрицательный, поскольку значение dT в этой точке становится величиной отрицательной. На самом деле этого не происходит и теплота продолжает поступать к рабочему телу. Далее п2 возрастает до значений 1,3 – 1,4 - признак адиабатного участка, подтверждающего окончание подвода тепла к рабочему телу, или, иначе, окончание видимого сгорания. Следует отметить, что на графике кривая п2 не продолжена в сторону ВМТ, где п2 стремится к - ∞, что свидетельствует о наличии в области ВМТ признаков изохорного процесса.
Подобное изменение n2 на графике могло также означать только одно: величина с в реальных газовых процессах изменяется: от сv при изохоре и ср при изобаре до ± ∞ при изотерме и последующем снижении до нуля при адиабате. Таким образом, можно утверждать, что к 1935 году наличие в газовых процессах двигателей внутреннего сгорания феномена с = var было доказано экспериментально.
Известно, что (Вукалович, стр 74) при изменении состояния идеального газа по политропе от температуры Т1 до температуры Т2 количество теплоты, подводимой или отводимой от газа, определяется выражением
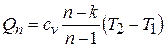 . (1)
. (1)
Из представленной зависимости следует, что количество теплоты при заданном n однозначно определяется разностью между показателями политропы и адиабаты, а такжеразностью температур между начальной и конечной точками процесса. Указанная зависимость также не отражает влияние температуры на величину показателя адиабаты. теплоёмкость политропного процесса
cnол = cv (n – k) / (n – 1).
Исследование реальных процессов в двигателе показало, что удовлетворительное совпадение теоретического и реального процессов удаётся достичь только в случае изменения величины n в ходе процесса, что отражено в уравнениях термотропного процесса.
 2014-02-09
2014-02-09 5165
5165








