ВЫВОДЫ
1.Изоморфная модель отражает все характеристики и особенности
функционирования реальной ХТС, гомоморфные модели упрощенно
отображают наиболее существенные процессы функционирования
системы
2. Оптимизация ХТС – это операция определения значений параметров технологических режимов, конструкционных и технологических параметров элементов, которые обеспечивают оптимальное значение КЭ функционирования ХТС
3.Синтез ХТС – это операция создания ХТС для производства заданной химической продукции с учетом требований к
функционированию ХТС
Лекция 7 Эксергетический баланс. Классификация химических реакторов
1. МАТЕРИАЛЬНЫЙ И ЭНЕРГЕТИЧЕСКИЙ БАЛАНСЫ
1.Эксергетический баланс. Эксергетический КПД
2. Классификация химических реакторов.
3.Математическая модель реактора идеального смешения перидического и непрерывного действия.
При разработке химико-технологических процессов проводятся разнообразные расчеты для количественной оценки протекающих операций, а также для определения оптимальных значений параметров технологического процесса. Во всех случаях при расчетах учитываются законы гидродинамики, тепло-и массопередачи и химической кинетики, поэтому расчеты материальных потоков обычно сочетаются с энергетически-
ми расчетами, для этого составляют материальный и энергетический балансы.
Материальный баланс – это вещественное выражение закона сохранения массы вещества, согласно которому во всякой замкнутой системе масса веществ, вступивших во взаимодействие, равна массе веществ, образовавшихся в результате этого взаимодействия, т.е. приход вещества Σ B прих равен его расходу Σ B расх.
Таким образом, уравнение материального баланса можно представить в виде
Σ B прих = Σ B расх.
Для периодических процессов материальный баланс составляют в расчете на одну операцию, для непрерывных процессов – за единицу времени.
Материальный баланс составляют по уравнению основной суммарной реакции с учетом параллельных и побочных реакций. Он может быть составлен для всех веществ, участвующих в процессе, или только для одного какого-либо вещества. Обычно учитываются не все протекающие реакции и получаемые побочные продукты, а лишь те, которые имеют существенное значение, т.е. материальный баланс носит приближенный характер. Материальный баланс составляют для процесса в целом или для отдельных его стадий. При этом учет массы веществ производится отдельно для твердой, жидкой и газовой фаз, поэтому, в общем виде, материальные балансы выражаются обычно в виде уравнения
В т + В ж + В г = В т′ + В ж′ + В г′, (1)
где В т, В ж, В г – массы твердых, жидких и газообразных веществ, поступающих в производство или на анную операцию в единицу времени;
В′ т, В′ ж, В′ г – массы получаемых продуктов.
Иногда при проведении практических расчетов могут не приниматься во внимание отдельные фазы (твердая, жидкая или газообразная) либо в одной какой-либо фазе учитывается существование нескольких разных веществ, поэтому уравнение (1) соответственно упрощается или усложняется. При проектировании обычно задаются массой целевого продукта.
ство энергии, введенной в процесс, равно количеству выделяющейся энергии, т.е. приход энергии равен ее расходу.
ХИМИКО-ТЕХНОЛОГИЧЕСКИЕ ПРОЦЕССЫ СВЯЗАНЫ С ЗАТРАТОЙ РАЗЛИЧНЫХ ВИДОВ ЭНЕРГИИ – ТЕПЛОВОЙ, МЕХАНИЧЕСКОЙ, ЭЛЕКТРИЧЕСКОЙ. ПОСКОЛЬКУ В ЭТИХ ПРОЦЕССАХ ТЕПЛОВАЯ ЭНЕРГИЯ ИМЕЕТ НАИБОЛЬШЕЕ ЗНАЧЕНИЕ, ДЛЯ НИХ ОБЫЧНО СОСТАВЛЯЮТ ТЕПЛОВОЙ БАЛАНС.
В ЭТОМ СЛУЧАЕ ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ ФОРМУЛИРУЕТСЯ ТАК: ПРИХОД ТЕПЛА В ДАННОЙ ПРОИЗВОДСТВЕННОЙ ОПЕРАЦИИ Σ Q ПPИX ДОЛЖЕН
БЫТЬ РАВЕН РАСХОДУ ТЕПЛА В ТОЙ ЖЕ ОПЕРАЦИИ Σ Q PACX, Т.Е.
Σ Q ПPИX = Σ Q PACX (2)
ТЕПЛОВОЙ БАЛАНС СОСТАВЛЯЮТ ПО ДАННЫМ МАТЕРИАЛЬНОГО БАЛАНСА С УЧЕТОМ ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ РЕАКЦИЙ И ФИЗИЧЕСКИХ ПРЕВРАЩЕНИЙ, ПРОТЕКАЮЩИХ В АППАРАТЕ, А ТАКЖЕ С УЧЕТОМ ПОДВОДА ИЛИ ОТВОДА ТЕПЛА. В ОБЩЕМ ВИДЕ ТЕПЛОВОЙ БАЛАНС ВЫРАЖАЮТ УРАВНЕНИЕМ:
Q Т + Q Ж + Q Г + Q Ф + Q Р + Q П = Q′ Т + Q′ Ж + Q′ Г + Q′ Ф + Q′ Р + Q′ П, (3)
ГДЕ Q Т, Q Ж, Q Г – ТЕПЛО, ВНОСИМОЕ С ПОСТУПАЮЩИМИ В АППАРАТ ТВЕРДЫМИ, ЖИДКИ-
МИ И ГАЗООБРАЗНЫМИ МАТЕРИАЛАМИ;
Q′ Т, Q′ Ж, Q′ Г – ТЕПЛО, УНОСИМОЕ ВЫХОДЯЩИМИ МАТЕРИАЛАМИ;
Q Ф, Q′ Ф – ТЕПЛО, ВЫДЕЛЯЕМОЕ И ПОГЛОЩЕННОЕ ПРИ ФИЗИЧЕСКИХ ПРО-
ЦЕССАХ;
Q Р, Q′ Р – ТЕПЛО ЭКЗО- И ЭНДОТЕРМИЧЕСКИХ РЕАКЦИЙ;
Q П, Q′ П – ТЕПЛО, ПОДВОДИМОЕ В АППАРАТ ИЗВНЕ И ВЫВОДИМОЕ ИЗ НЕГО.
НЕКОТОРЫЕ ИЗ ПРИВЕДЕННЫХ СТАТЕЙ ПРИХОДА (ИЛИ РАСХОДА) МОГУТ ОТСУТСТВОВАТЬ, ТОГДА УРАВНЕНИЕ (3) СООТВЕТСТВЕННО УПРОЩАЕТСЯ.
Балансовые уравнения, базирующиеся на законах сохранения и превращения массы и энергии, дополняют эксергетическим балансом, основанным на одновременном учете первого и второго начал термодинамики.
Уравнение эксергетического баланса в общем виде имеет следующий вид:
Σ Е`= ΣЕ``+D
где Σ Е`и ΣЕ – входящие и выходящие потоки эксергии D – потоки эксергии
Разность между приходом и расходом эксергии представляет собой потери эксергии вследствие необратимого теплообмена:
D =(E1 – E2) – (E4 – E1)
Эти потери можно рассчитать без определения эксергии потоков, зная только энтропии теплоносителей:
D1 = T0 ΔS = T0 (S4 – S3)- (S1 - S2)
• Для эксергии неприменим общий закон сохранения: сумма эксергии всех элементов системы в ходе процесса уменьшается;
• только при отсутствии потерь (в обратимом процессе) сумма эксергии до и после процесса остается постоянной; в каждом необратимом процессе эксергия преобразуется в энергию.
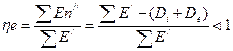 |
• называется эксергетическим КПД, который всегда меньше единицы. Эксергетический КПД показывает степень приближения системы к идеальной. Для идеального процесса, где потери эксергии отсутствуют, n e, = 1, или 100%. Если же подведенная эксергия полностью теряется в процессе, то ne = 0.
 2014-02-09
2014-02-09 1307
1307








