К электрохимическим способам защиты металлов от коррозии относятся протекторная и катодная защиты:
По механизму защитного действия этот вариант аналогичен анодному покрытию. К защищаемой конструкции, находящейся в среде электролита, присоединяется более активный металл. В образующейся гальванопаре, за счет коррозии более активного металла, происходит поляризация электронами защищаемой конструкции. В качестве металла-протектора применяются Мg, Zn, Аl и другие активные металлы или их сплавы. Необходимым условием протекторной защиты является электропроводящий контакт конструкции с металлом-протектором.
Химизм протекторной защиты железа цинком в нейтральной среде:
Анодный процесс: Zn = Zn2+ + 2e.
Катодный процесс: O2 + 2H2O + 4e =4ОH-.
Суммарное уравнение: 2Zn + O2 +2H2O = 2Zn(ОH)2.
2) Катодная защита.
Сущность данного способа защиты от коррозии заключается в том, что защищаемый металл, находящийся в среде электролита, подключается к катоду(–) внешнего источника тока. В качестве анода можно использовать любой металлический лом. В результате окислители окружающей среды восстанавливаются на защищаемом металле электронами от внешнего источника тока, а окисляется металлический лом. Такой способ защиты чаще всего применяют для крупных конструкций, находящихся в среде электролита.
ТЕМА 5
ОСНОВНЫЕ ЗАКОНОМЕРНОСТИ ПРОТЕКАНИЯ ХИМИЧЕСКИХ ПРОЦЕССВ
ЛЕКЦИЯ № 12
Науку о взаимных превращениях различных видов энергии называют термодинамикой. Термодинамика устанавливает законы этих превращений, а также направление самопроизвольного протекания различных процессов.
1 Энергетика химических процессов.
Внутренняя энергия и энтальпия
Химические реакции сопровождаются выделением или поглощением тепла. Тепловой эффект реакции в основном определяется разницей между энергиями разрыва химических связей исходных веществ и образования связей в продуктах реакции.
В любом процессе соблюдается закон сохранения энергии. Теплота (Q), поглощенная системой, идет на изменение её внутренней энергии(DU) и на совершение работы (А):
Q = ΔU + A.
Внутренняя энергия системы U – это общий запас энергии системы. Абсолютные значения внутренней энергии веществ неизвестны, так как нельзя привести систему в состояние, лишенное энергии, поэтому на практике пользуются её изменением ΔU. Внутренняя энергия является функцией состояния, то есть её изменение однозначно определяется начальным и конечным состоянием системы и не зависит от пути перехода, по которому протекает процесс. Изменение внутренней энергии системы измеряют при постоянном давлении, то есть в изохорно-изотермическом процессе (v – const, T – const).
ΔU = U2 - U1,
где ΔU - изменение внутренней энергии системы,
U2 – энергия продуктов реакции, U1 – энергия исходных веществ.
Теплота и работа функциями состояния не являются, т.к. они служат формами передачи энергии и связаны с процессом, а не с состоянием системы.
Энтальпия (Н) применяется случае проведения процесса при постоянном давлении, то есть в изобарно-изотермических (p – const, T – const) и является функцией состояния. На практике пользуются также изменением энтальпии
ΔH = H2 - H1.
Стандартные условия: Т – 298 К, р– 1атм, n – 1моль, агрегатное состояние и кристаллическая модификация – наиболее устойчивые при стандартных условиях. Стандартные условия для изменения энтальпии обозначаются 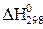 . Для простых веществ в стандартных условиях
. Для простых веществ в стандартных условиях 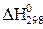 условно приняли равным 0.
условно приняли равным 0.
Примеры:
1) 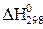 (Н2ОЖ) = -285,8 кДж/моль, т.е. при стандартных условия образование жидкой воды из простых веществ (Н2 и О2) сопровождается выделением 285,8 кДж энергии.
(Н2ОЖ) = -285,8 кДж/моль, т.е. при стандартных условия образование жидкой воды из простых веществ (Н2 и О2) сопровождается выделением 285,8 кДж энергии.
2) 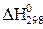 (Н2Г) = 0 кДж/моль.
(Н2Г) = 0 кДж/моль.
В термодинамике в уравнениях химических реакций наряду с указанием теплового эффекта реакции, указываются агрегатные состояния веществ и допускаются дробные коэффициенты. В такой форме записи уравнения называются термохимическими.
Пример:
Н2(г) + ½ О2(г) = Н2О(ж), 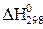 = -285,8 кДж/моль.
= -285,8 кДж/моль.
 2014-02-09
2014-02-09 4004
4004
