Тепловой эффект химической реакции равен разности между суммой энтальпий образования продуктов реакции и суммой энтальпий образования исходных веществ (с учетом стехиометрических коэффициентов в виде соответствующих множителей)
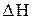 реакции = S ni DНобр. продуктов - S nj DНисх. веществ.
реакции = S ni DНобр. продуктов - S nj DНисх. веществ.
2) Тепловой эффект реакции равен разности между суммой энтальпий сгорания исходных веществ и суммой энтальпий сгорания продуктов реакции (с учетом стехиометрических коэффициентов в виде соответствующих множителей). его обычно применяют для реакций органических соединений)
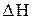 реакции = S nj DНсгорания исх. веществ -S ni DНсгорания обр. продуктов.
реакции = S nj DНсгорания исх. веществ -S ni DНсгорания обр. продуктов.
Закон Гесса и его следствия можно применять не только для химических превращений, но и для расчета тепловых эффектов фазовых переходов: плавления, кипения, кристаллизации, растворения и др.
Имея справочные или экспериментальные значения по теплотам образования (или сгорания) веществ, можно рассчитать тепловой эффект химической реакции. В таблице 1 приведены значения энтальпий образования некоторых веществ.
Таблица 1 – Стандартные энтальпии образования (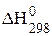 ) некоторых веществ
) некоторых веществ
| Вещест- во | Состоя- ние | 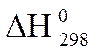 , кДж/моль , кДж/моль | Вещество | Состояние | 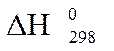 , кДж/моль , кДж/моль |
| CH4 | г | -74,85 | Н2О | ж | -285,84 |
| C2 H6 | г | -84,67 | Н2О | г | -241,83 |
| C2 H2 | г | +226,75 | СО | г | -110,52 |
| C2 H4 | г | +52,28 | СО2 | г | -393,51 |
| C6 H6 | г | +82,93 | Са(ОН)2 | к | -986,50 |
| NH3 | г | -46,19 | Fe2О3 | к | -822,10 |
Примеры расчета тепловых эффектов химических реакций:
С2Н6(г) + 31/2О2 = 2СО2(г) + ЗН2О(ж), DН0298 = -1559,87 кДж.
 2014-02-09
2014-02-09 2887
2887
