Движущая сила процесса складывается из двух сил: стремления к упорядочению (DН) и стремления к беспорядку (TDS).
При p и T = const общую движущую силу процесса обозначают DG и вычисляют по формуле
DG = DH - TDS.
Величина G называется изобарно-изотермическим потенциалом или энергией Гиббса. Итак, мерой химического сродства является убыль энергии Гиббса (DG), которая зависит от природы вещества, его количества и от температуры. Энергия Гиббса является функцией состояния, поэтому
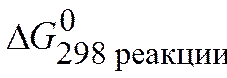 =
=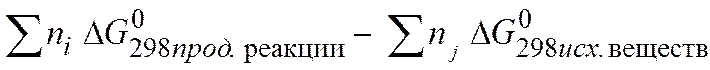 .
.
Вычислив изменение DG в ходе процесса, можно сделать следующие выводы:
DG < 0 – самопроизвольно протекает прямой процесс,
DG > 0 – самопроизвольно протекает обратный процесс,
DG = 0 –состояние равновесия.
В таблица 3 приведены стандартные значения энергии Гиббса (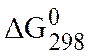 ) образования некоторых веществ
) образования некоторых веществ
Таблица 3 – Стандартные значения энергии Гиббса (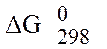 ) образования некоторых веществ
) образования некоторых веществ
| Веще- ство | Состо- яние | DG°298, кДж/моль | Вещество | Состо- яние | DG°298, кДж/моль |
| СО | г | -137,27 | Н2О | г | -228,59 |
| СО2 | г | -394,38 | Н2О | ж | -237,19 |
| FeO | к | -244,3 | NO2 | г | +51,84 |
| Fe3O4 | к | -1014,2 | СН4 | г | -50,79 |
| ВаО | к | -528,4 | С2Н2 | г | +209,20 |
Пример
Вычислить DН0298, DS0298, DG°т реакции, протекающей по уравнению:
Fe2O3(к) + ЗС(к) = 2Fe(к) + ЗСО(г).
Возможна ли реакция восстановления Fе2О3 углеродом при температурах 500 и 1000 К?
Решение. DН0298, DS0298 являются функциями состояния, поэтому находим их, используя математическое выражение следствия из закона Гесса:
DН0298 = 3(-110,52) + 2×0 - (-822,10 + 3×0) = -331,56 + 822,10 = +490,54 кДж,
DS0298 = (2×27,2 + 3 ×197,91) - (89,96 + 3×5,69) = 541,1 Дж/К.
Энергию Гиббса при соответствующих температурах находим из соотношения DG°t = DН0298 - TDS0298:
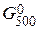 = 490,54 – 500×541,1/1000 = +219,99 кДж,
= 490,54 – 500×541,1/1000 = +219,99 кДж,
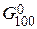 = 490,54 – 1000×541,1/1000 = -50,56 кДж.
= 490,54 – 1000×541,1/1000 = -50,56 кДж.
Так как 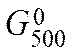 > 0, a
> 0, a 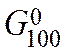 < 0, то восстановление Fе2О3 углеродом возможно при 1000 К и невозможно при 500 К.
< 0, то восстановление Fе2О3 углеродом возможно при 1000 К и невозможно при 500 К.
Термодинамические величины (U, Н, S, G) являются функциями состояния, поэтому изменение их в ходе процесса можно вычислять используя математические выражения следствий из закона Гесса. При решении задач следует учитывать, что как правило ΔU, DН и DG выражают в кДж, а S – в Дж.
Зная значению DG0т можно найти константу равновесия из формулы:
DG0т = – R·T·lnKp
ЛЕКЦИЯ № 13
«ХИМИЧЕСКАЯ КИНЕTИКА»
Химическая кинетика – учение о скоростях и механизмах протекания химических реакций.
1 Скорость реакции
Скорость химической реакции – это изменение концентрации (ΔC) реагирующих веществ за единицу времени(Δt)
Vср = ±Δс/Δt.
Знак «+» ставится, если скорость контролируется по образующемуся продукту, а знак «–» — по расходу исходного вещества.
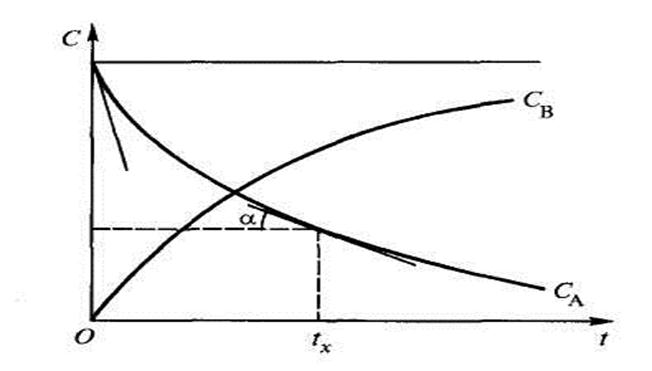
 По результатам измерений концентраций во времени строят так называемые кинетические кривые.
По результатам измерений концентраций во времени строят так называемые кинетические кривые.
Например, в ходе реакции А ® В концентрация исходного вещества А уменьшается, а продукта реакции В – увеличивается и кинетическая кривая имеет вид (рисунок 1).
В зависимости от количества фаз все системы и протекающие в них реакции делятся на гомогенные и гетерогенные.
Гомогенные реакции протекают в одной фазе. Например, реакция взаимодействия между хлором и водородом, приводящая к образованию хлороводорода, является гомогенной так как все вещества находятся в газообразном состоянии
Cl2(г) + H2(г) = 2HCl(г).
Гетерогенные реакции протекают на поверхности раздела фаз. Примером гетерогенной реакции может служить реакция горения, протекающая на границе уголь-кислород (система, состоящая из двух фаз)
С(к) + О2(г) = СО2(г).
2 Факторы, влияющие на скорость химических реакций
1) Природа реагирующих веществ,
2) Концентрация реагирующих веществ,
3) Температура,
4) Наличие посторонних веществ.
2.1 Влияние концентрация реагирующих веществ на скорость химической реакции.Закон действующих масс
С увеличением концентрации скорость реакции возрастает, так как чаще происходят столкновения молекул реагирующих веществ. Количественно эта зависимость определяется законом действующих масс.
Закон действующих масс (1867г.) — скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для гомогенной реакции mА + пВ = С
уравнение скорости реакции имеет вид
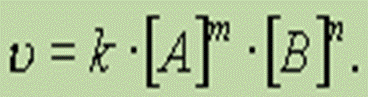
Входящая в уравнение константа скорости К — это скорость реакции при концентрациях реагирующих веществ равных единице.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
Пример
Напишем выражение закона действующих масс для следующих реакций:
1) N2(г) + 3H2(г) = 2NH3(г);
2) 2C(к) + O2(г) = 2CO(г).
Решение
1) u=[N2]·[H2]3.
Данная система являться гомогенной.
2) u=[О2].Данная система являться гетерогенной, поэтому в формулу закона действующих масс входят концентрации только газообразных веществ.
2.2 Влияние температуры на скорость химической реакции. Правило Вант-Гоффа. Уравнение Аррениуса
 2014-02-09
2014-02-09 2940
2940
