Энтропия
Энтропия (S) - мера беспорядка системы.
S = k· lgW,
где, k – коэффициент пропорциональности,
Энтропия также является функцией состояния, размерность её 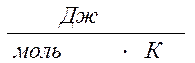 .
.
В изолированной системе самопроизвольно могут протекать только такие реакции или фазовые переходы, которые ведут к увеличению неупорядоченности системы, т.е. к увеличению энтропии.
В отличие от внутренней энергии и энтальпии для энтропии известны абсолютные значения. Это стало возможным благодаря постулату Планка – энтропия любого простого вещества при 0 К принята равной нулю.
При повышении энтропия возрастает. В случае фазовых переходов (плавление, кипение, конденсация и т.д.) изменение энтропии происходит скачкообразно.
Применяя закон Гесса или его следствия и имея данные по энтропиям веществ, можно рассчитать изменение энтропии в ходе химической реакции или фазового перехода. В таблице 2. приведены стандартные значения энтропий некоторых веществ.
Таблица 2 – Стандартные абсолютные значения энтропий (S°298) некоторых веществ
| Вещество | Состо- яние | S°298, Дж/(моль К) | Вещест- во | Состо- яние | S°298, Дж/(моль К) |
| С | Алмаз | 2,44 | H20 | ж | 69,94 |
| С | Графит | 5,69 | Н20 | г | 188,72 |
| Fe | к | 27,2 | NH3 | г | 192,50 |
| Fe203 | к | 89,96 | С2Н2 | г | 200,82 |
| СО | г | 197,91 | С2Н4 | г | 219,54 |
| СО2 | г | 213,65 | 02 | г | 205,03 |
 2014-02-09
2014-02-09 871
871








