Р-ЭЛЕМЕНТЫ V ГРУППЫ
Германий. Олово. Свинец
Кремний
Кремний - один из самых распространённых в земной коре элементов. В природе кремний встречается в виде SiО2 – диоксида кремния (кремнезём, песок, кварц) или в виде различных алюмосиликатов, например, каолина (А12О3·2SiО2·2Н2О), составляющего основу различных глин.
Чистый кремний - кристаллическое вещество со стальным блеском. Область применения - радиоэлектроника (полупроводниковая техника).
Кремний энергично взаимодействует с растворами щелочей с образованием силикатов и выделением водорода
Si + 2 КОН + Н2О = К2 SiО3 + 2 Н2↑.
Диоксид кремния (SiО2) - кислотный оксид, непосредственно с водой не взаимодействует. Ему соответствуют слабые малорастворимые в воде кремниевые кислоты. Из солей кремниевых кислот (силикатов) растворимы лишь силикаты калия и натрия (жидкое стекло.
В ряду Gе – Sn –Рb наблюдается усиление металлических свойств. Данные элементы проявляют в своих соединениях степени окисления +2 и +4. Для свинца более устойчива степень окисления окисления +2, поэтому соединения в степени окисления +4 обладают сильными окислительными свойствами:
РbО2 + 4НСl = РbСl4 + 2Н2О,
РbСl4 = РbСl2 + Сl2↑.
Как отмечено ранее, данные металлы являются амфотерными, т.е взаимодействуют с кислотами и щелочами:
Sn + 4Н2SО4 + 2 Н2О = Sn(SО4) 2 + SО2 + H2О↑,
Sn + 2 КОН + 2 Н2О = К2[Sn(ОН)4] + H2↑.
Взаимодействие свинца в разбавленных Н2SО4 и НС1 затруднено из-за образования на его поверхности малорастворимых РbSО4 и РbС12.
Германий обладает полупроводниковыми свойствами и на этом основано его основное применение.
Олово очень пластично и легко прокатывается в тонкие листы, называемые оловянной фольгой или станиолем.
Применение свинца разнообразно: пластины аккумуляторов, аппаратура на сернокислотных заводах, боеприпасы и дробь, припой, сплав для подшибников и типографский сплав (гарт).
ЛЕКЦИЯ № 19
«СВОЙСТВА Р-ЭЛЕМЕНТОВ
V и VI ГРУПП»
В главную подгруппу V группы входят элементы: азот (N), фосфор (Р), мышьяк (Аs), сурьма (Sb) и висмут (Вi). На внешнем энергетическом уровне атомов этих элементов находятся по пять электронов. Электронная формула валентной зоны атомов имеет вид – ns2np3, а энергетическая диаграмма соответственно вид, представленный на рис. 1.
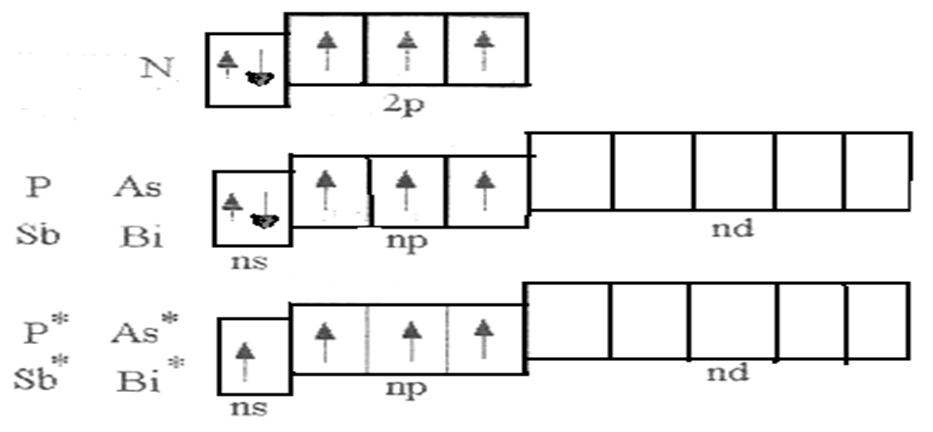
Рисунок 1. Энергетические диаграммы валентных зон р-элементов V группы
Из рисунка 1 видно, что данные элементы могут быть трех и пяти валентны. Максимальная валентность азота равна четырем (три связи могут быть образованы по обменному механизму и одна – по донорно-акцепторному).
Основные степени окисления данных элементов -3, 0, +3 и +5. При этом для азота возможны все степени окисления: -3; -2; -1; 0; +1; +2; +3; +4; +5. Для висмута наиболее устойчивая степень окисления +3, поэтому соединения Вi+5 обладают сильными окислительными свойствами.
В подгруппе с увеличением порядкового номера уменьшаются неметаллические свойства и усиливаются металлические. Сурьма относятся к металлам, так как имеют характерный металлический блеск и присущую металлам электро- и теплопроводность.
 2014-02-09
2014-02-09 1044
1044








