D -МЕТАЛЛЫ VIII ГРУППЫ
При взаимодействии с соляной кислотой вначале протекает реакция нейтрализации, а затем образующийся хлорид марганца (IV) разлагается по внутримолекулярной окислительно-восстановительной реакции
МnО2 + 4НСl = МnСl4 + 2Н2О,
Мn+4Сl-4 = Мn+2Сl2 + Сl02↑.
Наиболее широко применяемое соединение семивалентного марганца - перманганат калия КМпО4. Соединения марганца в высшей степени окисления -+7, в частности перманганаты, являются сильными окислителями. Степень восстановления перманганата калия зависит от рН среды:
1) В кислой среде восстанавливается до +2
2КМnО4 + 5К2SО3 + 3Н2SО4 = 2 МnSО4 + 6К2SО4 + 3Н2О,
2) В нейтральной до +4
2 КМnО4 + 3 К2SО3 + Н2О = 2 МnО2↓ + 3 Na2SО4 + 2КОН,
3) В щелочной среде до +6
2 КМnО4 + К2SО3 + 2КОН = 2К2МnО4 + К2SО4 + КОН.
При нагревании в сухом виде перманганат калия применяется для получения в лабораторных условиях кислорода
2 КМnО4 = К2МnО4 + МnО2 + О2.
Марганец преимущественно применяется для получения специальных сортов стали. Сплав манганин (12% Мn, 3% Ni) обладает высоким электрическим сопротивлением. В виде ферромарганца при выплавке стали используется для удаления кислорода (раскисление) и серы.
Из соединений технеция практический интерес представляют пертехнаты, являющиеся эффективными ингибиторами коррозии железа в воде даже при температуре 250 0С.
Рений и его сплавы применяются в электрических лампах и электровакуумных приборах. Жаропрочные и тугоплавкие сплавы рения с вольфрамом, молибденом, танталом применяются для изготовления некоторых ответственных деталей.
d-металлы VIII группы включают три триады. В четвертом периоде это триада железа, а в пятом и шестом – две триады, объединённые под общим названием платиновые металлы.
В триаду железа входят: железо(Fе), кобальт (Со) и никель(Ni). Это основные конструкционные металлы.Электронные конфигурация данных атомов имеют соответственно вид: 3d64s2. 3d74s2. 3d84s2. Наиболее устойчивые степени окисления для железа +2, +3 и +6, а для кобальта и никеля +2, +3.
Для железа наиболее устойчива при обычных условиях степень окисления +3, поэтому соединения железа +2 являются сильными восстановителями, а +6 – сильными окислителями. Для кобальта и никеля наиболее устойчива степень окисления+2, а в степени окисления +3 они обладают сильными окислительными свойствами.
В таблице 2 приведены основные классы соединений, образуемых железом.
Таблица 2. Основные классы соединений железа
| +2 | +3 | +6 | |
| Оксиды | FеО (основной) оксид железа (II) | Fе2О3 (амфотерный) оксид железа (III) | FеО3 (кислотный) оксид железа (VI) |
| FеО + Fе2О3 = Fe3О4 смешанный оксид | |||
| Гидроксиды | Fе(ОН)2 гидроксид железа (II) | Fе(ОН)3 гидроксид железа (III) НFеО2 мета-железистая кислота Н3FеО3 орто-железистая кислота | Н2FеО4 железная кислота 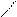 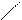  Н–О О Н–О О 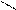 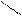 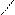 Fе Н–О О Fе Н–О О |
| Соли | FеСl2 хлорид железа (II) | FеСl3 хлорид железа (III) К3СrО3 – феррит калия | К2FеО4 феррат калия |
На примере железа в таблицы 24.1 приведен системный анализ основных классов неорганических соединений.
Железо, кобальт и никель - активные металлы, находящийся в ряду напряжений до водорода. На воздухе окисляются с образованием соответствующих оксидов. Накаленное железо сгорает по реакции
4Fe + 3О2 = Fe2О3.
В мелкораздробленном состоянии (диаметр частиц около 5 мкм ) самовоспламеняются на воздухе, т.е. обладают пирофорными свойствами.
Железо при температуре красного каления (~500 0С) окисляется водой
3Fe + 4Н2О = Fe2О3 + H2.
Оксид железа (II) FeO и соответствующий ему гидроксид Fe(OH)2 обладают основными свойствами; оксид железа (III) Fe2О3 проявляет амфотерные свойства растворяется в кислотах, а при сплавлении со щелочами образует соли железистой кислоты - метаферриты:
Fe2О3 + 6 НС1 = 2 FeCl3 + 3 Н2О;
Fe2О3 + 2 NaOH = 2NaFeО2 + H2О.
Смешанный оксид железа (II, III) – Fe3О4 можно рассматривать как соль, образованную при взаимодействии основного оксида (FeO) и амфотерного оксида(Fe2О3) с образованием соли Fe(FeО2)2 - метаферрит железа (II). Структурную формулу данной соли можно представить следующим образом
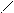 О – Fe = О
О – Fe = О
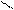 Fe
Fe
О – Fe = О
Соединения железа (II) проявляют восстановительные свойства и легко окисляются до соединений железа (III). Например, белый гидроксид железа (II) уже в момент осаждения из растворов принимает зеленоватую окраску вследствие частичного окисления кислородом воздуха, а затем зелёный цвет изменяется на бурый в результате полного окисления Fe(OH)2 до Fe(OH)3
4 Fe(OH)2 + O2 + 2 Н2О = 4 Fe(OH)3.
Данная реакция используется для обезжелезивания воды.
 2014-02-09
2014-02-09 2407
2407
