АЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Карбоциклические,
Ациклические,
Взаимным влиянием атомов в молекуле.
Химическим строением,
Качественным и количественным составом,
ВВЕДЕНИЕ
ЛЕКЦИЯ 25
Платина, благодаря тугоплавкости и исключительной коррозионной стойкости, используется для изготовления химической аппаратуры. Хорошо растворяет водород, особенно в мелко раздробленном состоянии.
Палладий способен поглощать огромное количество водорода (до 900 объемов на 1 объем металла).
Иридий отличается от платины очень высокой температурой плавления (2450 0С), большей химической стойкостью. Из сплава 90% платины и 10% иридия изготовлены международные эталоны метра и килограмма. Благодаря трудноокисляемости и тугоплавкости применяются в электрических контактах, термопарах. Высокая стоимость ограничивает применение этих металлов в технике.
Это соединения основным элементом которых является углерод. В состав органических соединений может входить водород и все остальные элементы периодической таблицы. В отличие от небольшого числа неорганических соединений углерода, органических соединений насчитывается около миллиона. Возможность образования химических связей между атомами углерода и такое явление как изомерия приводит к практически бесконечному многообразию данных соединений.
Согласно теории химического строения, разработанной Бутлеровым в 1861 г., свойства соединений определяются:
Классификация органических соединений, основанная на строении и составе углеводородных цепей, включает три ряда:
3. Гетероциклические.
По виду атомов, входящих в состав органических соединений, различают: галогенпроизводные, кислородсодержащие, азотсодержащие, серосодержащие и другие. Существуют соединения со смешанными функциональными группами: спиртокислоты, аминоспирты, аминокислоты и т.д.
Ациклические, в зависимости от числа связей между атомами углерода, делятся на предельные и непредельные (этиленовые и ацетиленовые) углеводороды.
По правилам систематической номенклатуры ИЮПАК предельные углеводороды называются алканами.
В таблице 1 приведены формулы и агрегатные состояния при н.у.
| Формула | СН4 | С2Н6 | С3Н8 С4Н10 | |
| Структурная формула | СН4 | Н3С-СН3 | Н3С-СН2-СН3 Н3С- СН2-СН2-СН3 | |
| Название | метан | этан | пропан | бутан |
| t к., оС | -161,5 | -88,6 | -42,1 | -0,5 |
Формулы и названия следующих представитель класса предельных углеводородов: пентан – С5Н12, гексан – С6Н14, гептан – С7Н16, октан – С8Н18, нонан – С9Н20, декан – С10Н22.
Изменение состава молекулы на группу СН2 каждый раз приводит к новому веществу, которые отличаются по свойствам. Различие гомологов ясно проявляется в их физических свойствах. От СН4 до С4Н10 — газы; от С5Н12 до С16Н34 (при температуре до 20 °С) — жидкости, остальные при обычных условиях — твердые вещества.
С увеличением числа С-атомов в молекулах резко возрастает число изомеров предельных углеводородов. Метан, этан и пропан не имеют изомеров; бутанов С4Н10 существует два:
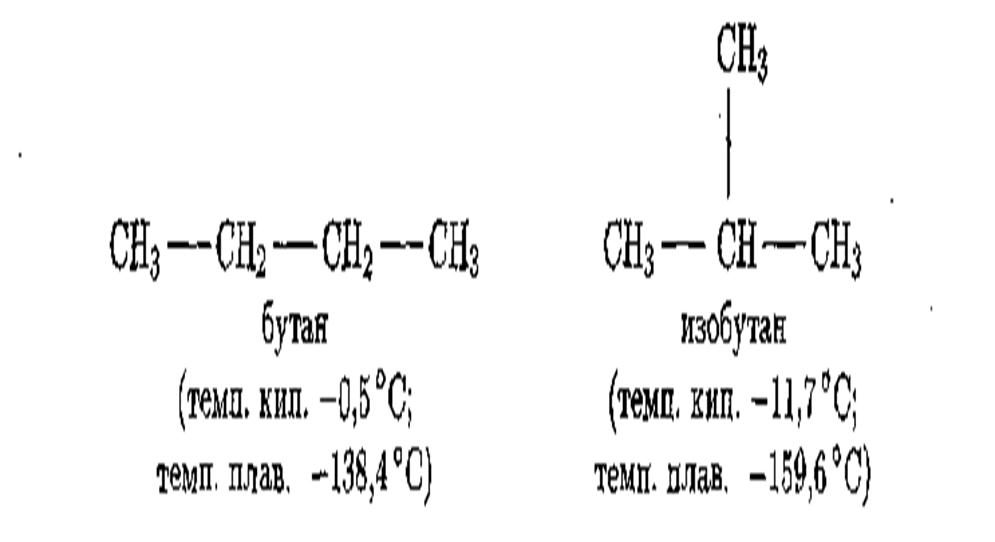
Изомерных пентанов — три, гексанов— пять, гептанов — девять, а деканов уже семьдесят пять и далее количество их нарастает в геометрической прогрессии.
 2014-02-09
2014-02-09 950
950








