Такие значения 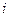 соответствуют случаю “жестких” молекул, в которы атомы не могут двигаться относительно друг друга. Ниже мы рассмотрим более общий случай.
соответствуют случаю “жестких” молекул, в которы атомы не могут двигаться относительно друг друга. Ниже мы рассмотрим более общий случай.
В курсе статистической физики будет доказан следующий закон.
Закон равномерного распределения энергии по степеням свободы.
На каждую степень свободы молекулы вещества в среднем приходится кинетическая энергия, равная 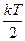 .
.
Мы доказали этот закон для частного случая идеального одноатомного газа:
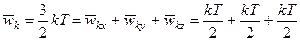 .
.
Для произвольного газа с числом степеней свободы молекул равным 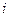
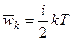 .
.
Рассмотрим теперь “нежесткую” двухатомную молекулу, в которой атомы связаны между собой посредством упругой силы. Такая молекула обладает тремя поступательными, двумя вращательными и одной колебательной степенью свободы. При малых амплитудах колеба-ния атомов будут гармоническими. В курсе механики было показано, что в этом случае средние за период колебаний значения кинетической и потенциальной энергии равны друг другу. Значит по закону равномерного распределения энергии на каждую колебательную степень свободы приходится энергия
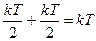 .
.
Колебательные степени свободы молекул газа при обычных температурах не проявляются. Они начинают влиять на теплоемкость газа при температурах порядка 10000С.
 2014-02-09
2014-02-09 405
405








