Зависимость скорости реакции от концентрации
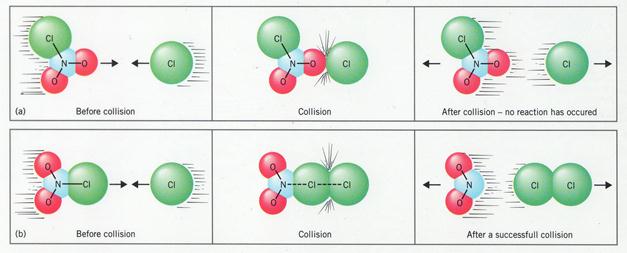
Протекание реакции в основном связано со столкновениями реагирующих частиц:
Чем выше концентрация → тем больше частиц в единице объема → тем чаще происходят столкновения между ними.
Скорость реакции возрастает с увеличением концентрации исходных веществ
Кроме того, частицы должны быть определенным образом сориентированы друг относительно друга в пространстве (стерический или геометрический фактор).
a A + b B +... → g G + h H +...
можно выразить уравнением

Величина k называется константой скорости реакции илиудельной скоростью (Erikiiruseks) и ее значение определяется экспериментально.
Константа скорости реакции зависит от конкретной реакции и условий ее проведения (например, температуры).
Константа скорости не зависит от концентрации исходных веществ.
Показатели степени, m, n,... называются частным порядком реакции по данному веществу.
Лишь в некоторых случаях они численно равны соответствующим стехиометрическим коэффициентам уравнения реакции.
Общим порядком реакции называется сумма концентрационных показателей степени
(m+ n +...).
Порядок реакции, как и константа скорости, определяется экспериментально.
Если известны (измерены) константа скорости реакции и начальные концентрации исходных веществ, можно рассчитать начальную скорость реакции.
 2014-02-09
2014-02-09 399
399








