Площадь соприкосновения веществ
Кинетика гетерогенных химических реакций
Для гетерогенной системы основной постулат химической кинетики становится неприменимым.
В гетерогенных реакциях роль промежуточных продуктов обычно играют молекулы, связанные химическими силами с поверхностью раздела фаз (химически адсорбированные на поверхности).
Во всяком гетерогенном химическом процессе можно выделить следующие стадии:
1. Диффузия реагентов к реакционной зоне, находящейся на поверхности раздела фаз.
2. Активированная адсорбция частиц реагентов на поверхности.
3. Химическое превращение адсорбированных частиц.
4. Десорбция образовавшихся продуктов реакции.
5. Диффузия продуктов реакции из реакционной зоны.
Стадии 1 и 5 называются диффузионными, стадии 2, 3 и 4 – кинетическими.
Универсального выражения для скорости гетерогенных химических реакций не существует, поскольку каждая из выделенных стадий может являться лимитирующей.
Как правило, при низких температурах скорость гетерогенной реакции определяют кинетические стадии (т.н. кинетическая область гетерогенного процесса; скорость реакции в этом случае сильно зависит от температуры и величины площади поверхности раздела фаз; порядок реакции при этом может быть любым).
При высоких температурах скорость процесса будет определяться скоростью диффузии (диффузионная область гетерогенной реакции, характеризующаяся, как правило, первым порядком реакции и слабой зависимостью скорости процесса от температуры и площади поверхности раздела фаз).
Площадь соприкосновения веществ оказывает влияние на скорость гетерогенных реакций.
На скорость таких реакций можно воздействовать путем:
§ Измельчения твердых веществ,
§ Распыления жидкостей,
§ Интенсивным перемешиванием веществ в ходе химической реакции.
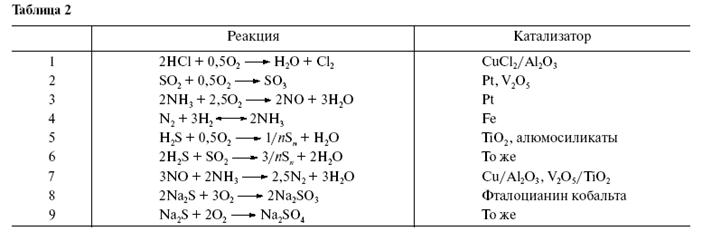
Катализаторы – это вещества, которые меняют скорость химической реакции, но по окончанию процесса восстанавливаются в первоначальном составе и количестве.
Чаще всего, под катализатором подразумевается вещество, которое ускоряет реакцию.
Вещество, которое замедляет ход реакции, называется ингибитором.
Механизм действия катализатора состоит в основном в преобразовании пути реакции во многоступенчатый процесс, причем энергия активации на каждом этапе ниже, чем энергия активации реакции без катализатора.
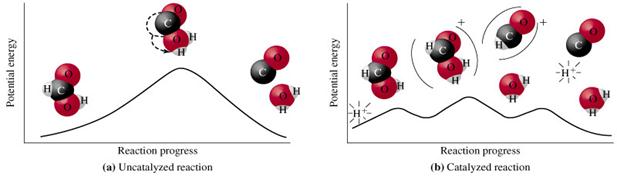
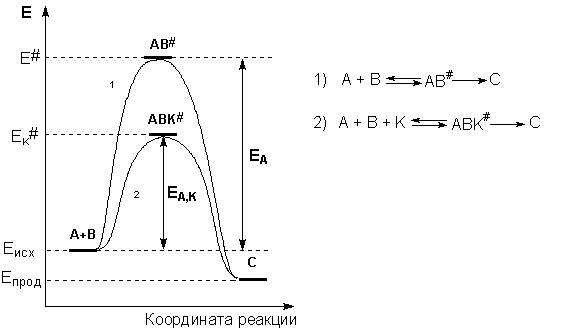
Влияние катализатора является селективным, т.е. катализатор влияет только на скорость определенной реакции.
| [Cu]: СО + Н2 ––> СН3ОН | [Al2О3]: С2Н5ОН ––> С2Н4 + Н2О |
| [Ni]: СО + Н2 ––> СН4 + Н2О | [Cu]: С2Н5ОН ––> СН3СНО + Н2 |
§ Гомогенный катализ – катализатор и реагирующие вещества находятся в одной и той же фазе (преимущественно в жидкой или газообразной)
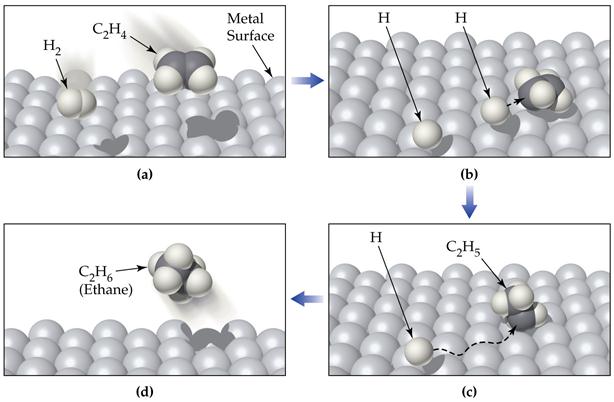
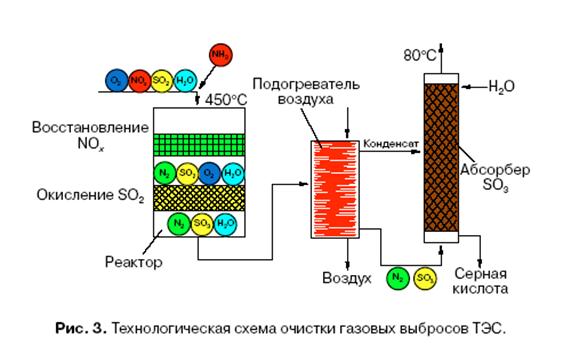
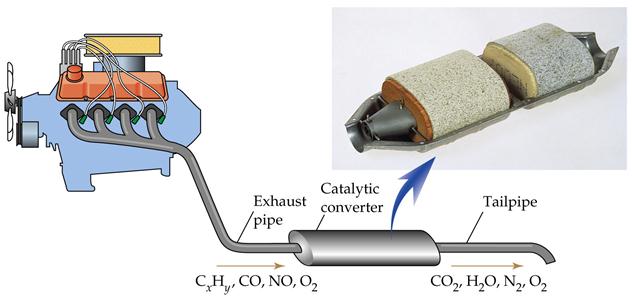
§ Гетерогенный катализ – катализатор представляет отдельную фазу (жидкую или твердую). В случае гетерогенного катализа образуются нестабильные промежуточные соединения на поверхности катализатора.
§ Промоторы – вещества, которые еще более усиливают действие катализатора. Они увеличивают число активных центров (дефектов кристалла) на поверхности катализатора.
§ Каталитические яды – адсорбируются на поверхности катализатора, препятствуя тем самым адсорбции реагентов, либо сами реагируют с катализатором (H2S, CO).
§ Катализ энзимами – очень специфический, имеющий большое значение в биохимии; катализаторы – энзимы.
§ Автокатализ – процесс каталитического ускорения химической реакции одним из её продуктов.
Пример: катализируемую ионами водорода реакция гидролиза сложных эфиров.
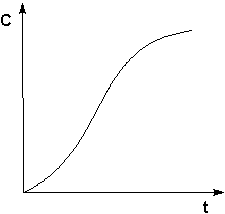
Кинетическая кривая продукта автокаталитической реакции.
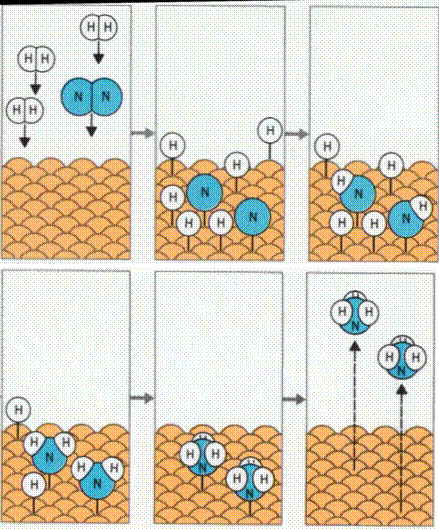
Пример гетерогенного катализа: синтез аммиака
Катализатор – железо, промоторы – К2О, Al2O3
| |||
| |||
 2014-02-09
2014-02-09 1172
1172








