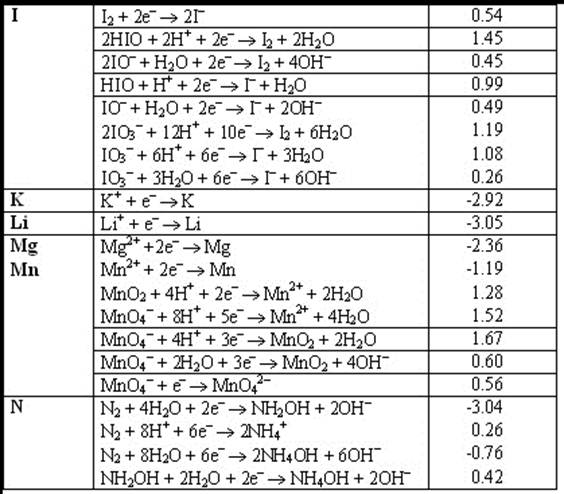
Электродные реакции
 |
Зависимость протекания химических реакций от времени изучает раздел химии «химическая кинетика». Помимо исследования скорости химических реакций кинетика изучает и механизмы протекания реакций.
Скорость химической реакции есть число элементарных актов химической реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности (для гетерогенных реакций).
 Скорость реакции определяется изменением количества/концентрации реагирующих веществ в единицу времени.
Скорость реакции определяется изменением количества/концентрации реагирующих веществ в единицу времени.
Единицей измерения обычно является: моль/л×с (изменение молярной концентрации в секунду) или моль/с.
Истинная скорость реакции выражается как производная концентрации по времени:
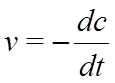
По изменению концентрации за определенный промежуток времени rt можно найти значение средней скорости реакции в данный период времени:
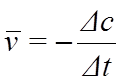
Экспериментально определяемая средняя скорость приближается к значению истинной скорость при уменьшении интервала времени rt.
rt→0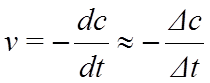
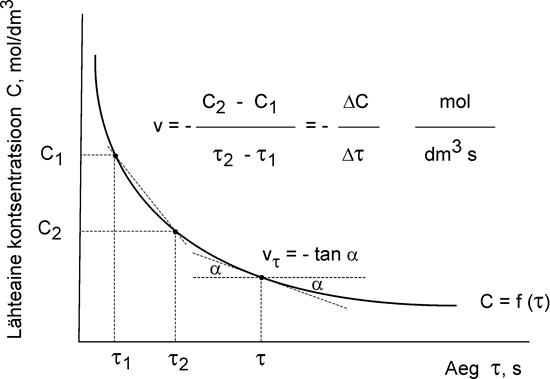
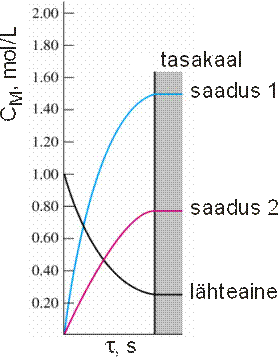
Кинетическая кривая – зависимость концентрации (с) от времени (τ).
· Скорость расходования вещества считается отрицательной величиной, скорость образования – положительной.
· Так как в ходе реакции концентрация исходного вещества уменьшается, то и скорость реакции обычно снижается со временем.
· Скорость реакции в целом считается равной скорости образования/разложения такого вещества, для которого стехиометрический коэффициент в уравнении реакции равен 1.
· Скорости образования/разложения других веществ пропорциональны соответствующим коэффициентам в уравнении реакции.
Пример:
 2014-02-09
2014-02-09 646
646







