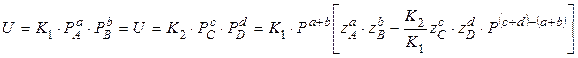
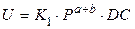
DC – движущая сила
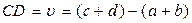
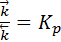 , тогда
, тогда
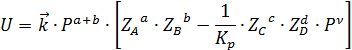
Константу равновесия можно выразить через энергию Гиббса:
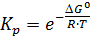
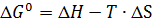
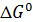 >0 для эндотермических реакций,
>0 для эндотермических реакций, 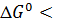 0
0 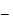 для экзотермической.
для экзотермической.
1) 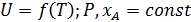

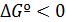
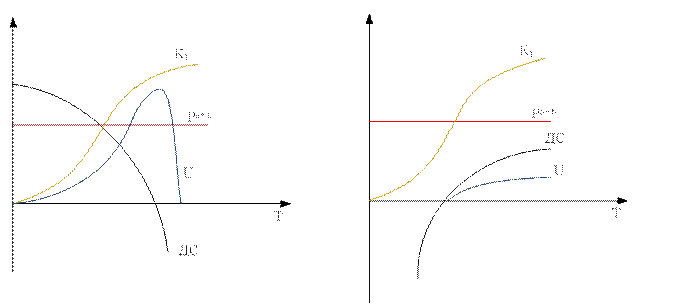
Для экзотермической реакции скорость увеличивается, потому что с ростом температуры возрастание константы скорости опережает снижение движущей силы. Затем скорость уменьшается, так как преобладает снижение движущей силы - наличие экстремума.
Для эндотермической реакции скорость так же увеличивается, потому что движущая сила увеличивается и константа скорости химической реакции увеличивается.
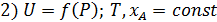
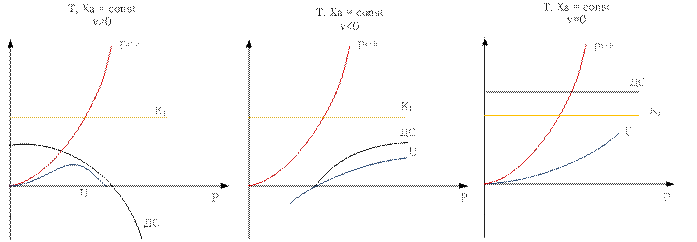
При увеличении давления возрастает величина Рa+b, следовательно увеличивается скорость реакции. С увеличением давления движущая сила химической реакции уменьшается, скорость реакции уменьшается.
Сувеличением давления скорость реакции всегда увеличивается.
2) 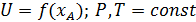
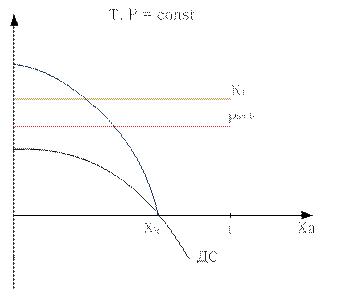
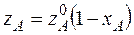
С увеличением степени превращения скорость реакции уменьшается, ибо уменьшается движущая сила (уменьшается концентрация реагента).
 2014-02-12
2014-02-12 1008
1008








