I. Рассмотрим экзотермическую реакцию:
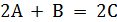
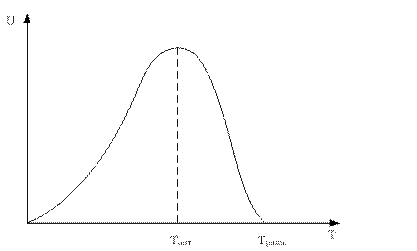
Зависимость скорости реакции от температуры.
1. Увеличим давление, а степень превращение ключевого компонента будем считать постоянной.
2. Увеличим степень превращения ключевого компонента при постоянном давлении.
Для этого необходимо оценить влияние давления Р на скорость химической реакции U, а также влияние давления на величину оптимальной Топт и равновесной Тр температур.
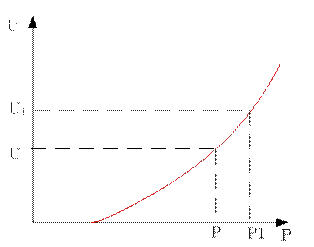
Для реакции, идущей с уменьшением молей газообразных реагентов.
Во всём диапазоне изменения давления увеличение давления приводит к увеличению скорости реакции.
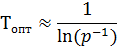
То есть с увеличением давления оптимальная температура будет возрастать.
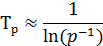
То есть с увеличением давления равновесная температура будет возрастать.
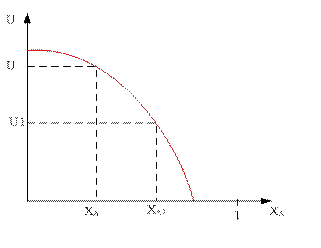
Зависимость скорости реакции от степени превращения ключевого компонента:
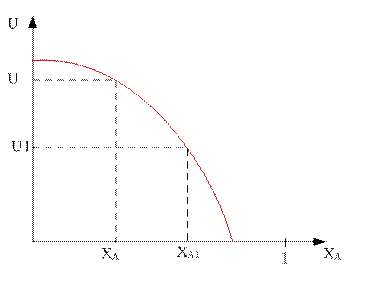
По мере увеличения степени превращения ключевого компонента А скорость реакции будет падать во всём диапазоне.
Из уравнений для вычисления значений оптимальной и равновесной температур показывает, что с увеличением степени превращения ключевого компонента А значения Топт и Тр уменьшаются.
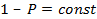
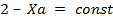
Рассмотрим зависимость скорости реакции от степени превращения ключевого компонента А в такой же экзотермической реакции:
1) Увеличим температуру при постоянном давлении.
2) Увеличим давление при постоянной температуре.
Рассмотрим первый случай.
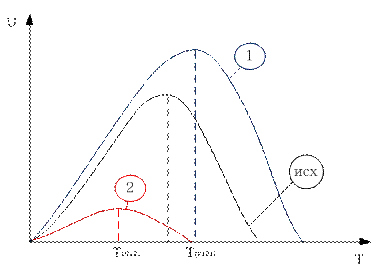
Зависимость скорости реакции от температуры:
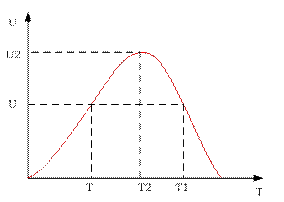
Существует диапазон температур 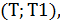 где скорость реакции будет больше, чем в базовом случае. Берём любую температуру
где скорость реакции будет больше, чем в базовом случае. Берём любую температуру  в этом диапазоне и показываем, что скорость увеличивается.
в этом диапазоне и показываем, что скорость увеличивается.
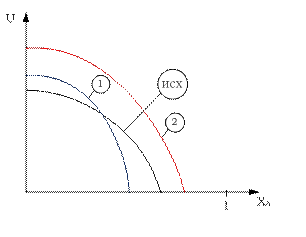
Первая зависимость будет смещена в сторону меньших степеней превращения и больших скоростей относительно исходной.
Рассмотрим второй случай.
С увеличением давления степень превращения ключевого компонента увеличивается.
Зависимость скорости реакции от давления:
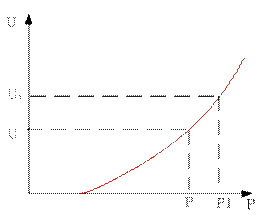
Вторая зависимость будет смещена в сторону больших степеней превращения и больших скоростей по сравнению с исходной.
Рассмотрим для все той же реакции зависимость скорости от давления.
скорости реакции от давления:
1) Увеличим температуру, а степень превращения ключевого компонента А будем считать постоянной.
2) Увеличим степень превращения ключевого компонента при постоянной температуре.
Рассмотрим первый случай.
Необходимо решить, куда сместится величина равновесного давления. Для этого приравняем скорость реакции к нулю и выразим давление:
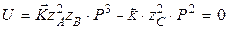
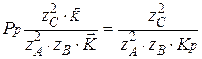
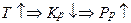 С увеличением температуры константа равновесия уменьшается и, следовательно, равновесное давление увеличивается.
С увеличением температуры константа равновесия уменьшается и, следовательно, равновесное давление увеличивается.
Первая зависимость будет смещена в сторону больших давлений и больших скоростей относительно исходной.
Рассмотрим второй случай.
Скорость реакции уменьшается с ростом степени превращения.
С увеличением степени превращения ключевого компонента концентрация продукта С увеличивается, следовательно дробь увеличивается и равновесное давление увеличивается:
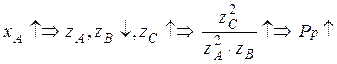
Вторая зависимостьсмещена относительно исходной в сторону больших давлений.
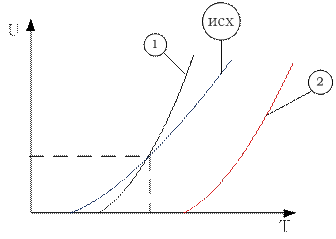
Обратимые системы необходимо рассматривать в двух состояниях:
когда система находится вдали от равновесия
когда система находится в состоянии равновесия.
II. Рассмотрим эндотермическую реакцию:

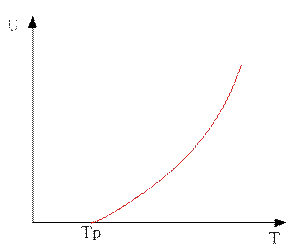
Зависимость скорости реакции от температуры.
1) увеличим давление, а степень превращения ключевого компонента А будем считать постоянной.
2) увеличим степень превращения ключевого компонента при постоянном давлении.
Рассмотрим первый случай.
С увеличением давления равновесная температура будет возрастать для эндотермической реакции.
Зависимость скорости реакции от давления для реакции, идущей с увеличением объёма газообразных реагентов.
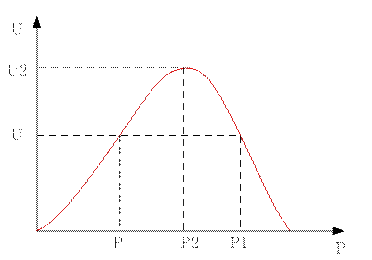
Для увеличения скорости необходимо увеличение давления в определённом диапазоне  Отсюда получаем, что зависимость с пересечением, которое означает, что существует температура, при которой скорость не будет зависеть от давления при данном составе.
Отсюда получаем, что зависимость с пересечением, которое означает, что существует температура, при которой скорость не будет зависеть от давления при данном составе.
Вторая зависимость будет смещена в сторону больших температур

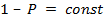
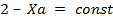
Рассмотрим зависимость скорости реакции от давления для той же эндотермической реакции.

1) увеличим температуру, а степень превращения ключевого компонента А будем считать постоянной.
2) увеличим степень превращения ключевого компонента при постоянной температуре.
3)
Рассмотрим первый случай.
Во всём диапазоне изменения температур увеличение давления приводит к увеличению скорости реакции.
Рассмотрим влияние температуры на равновесное давление.
Для того чтобы рассчитать равновесное давление, нужно приравнять скорость реакции к нулю и выразить давление
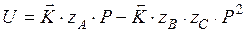
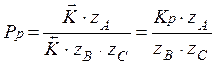
С увеличением температуры константа равновесия увеличивается, следовательно, равновесное давление увеличивается.
Для того чтобы рассчитать оптимальное давление, нужно приравнять производную скорости реакции по температуре к нулю и выразить давление.
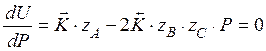
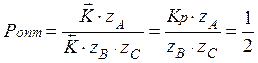
 с увеличением температуры константа равновесия увеличивается следовательно, оптимальное давление увеличивается.
с увеличением температуры константа равновесия увеличивается следовательно, оптимальное давление увеличивается.
Первая зависимость будет смещена в сторону больших давлений.
Рассмотрим второй случай.
С увеличением степени превращения ключевого компонента А, скорость реакции снижается во всём диапазоне.
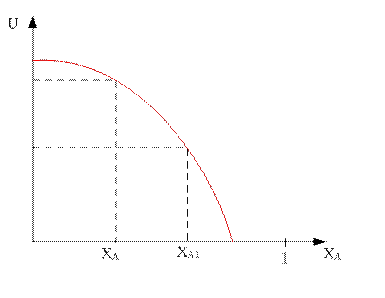
Степень превращения возрастет. Молярная доля продуктов возрастет, начальных компонентов упадет, следовательно оптимальное давление тоже упадет.
Вторая зависимость смещена относительно исходной в сторону меньших давлений.
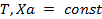
В основе метанольных топливных элементов лежит реакция:
СН3ОН = СО + 2Н2
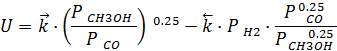
CO тормозит реакцию, так как находится в адсорбированном состоянии на катализаторе и неохотно его покидает. Это уравнение каталитической реакции.
Проанализируем, как будет зависеть скорость процесса от давления, при Т=const и ХСН3ОН=const.
применим закон Дальтона:
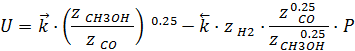
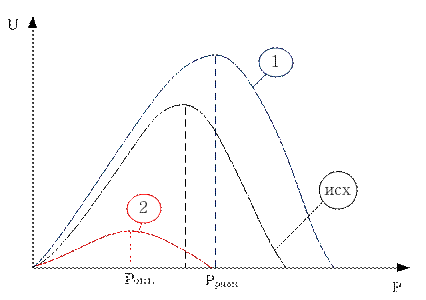
Скорость прямой реакции не зависит от давления, а скорость обратной реакции зависит от давления линейно.
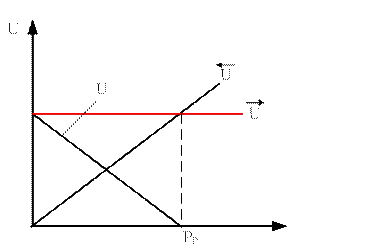
Для этой реакции наблюдаемая скорость уменьшается с ростом давления.
Таким образом, для данной реакции отсутствует понятие Ропт, а любое увеличение давления, выше атмосферного, приведет к снижению скорости. Отталкиваться нужно от Ратм.
 2014-02-12
2014-02-12 1829
1829








